题目内容
甲、乙两位同学分别设计了选用一种试剂进行除杂实验的方案(括号内为杂质,所选试剂均适量).请你对每个方案进行评价:
| 选项 | 待提纯的物质 | 选用的试剂 | 评价 | |
| 是否可行 | 简述理由 | |||
| A | NaCl(Na2CO3) | 盐酸 | ||
| B | Fe(Zn) | 稀硫酸 | ||
分析:根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
解答:解:A、Na2CO3能与稀盐酸反应生成氯化钠、水和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的试剂正确.
B、Fe和Zn均能与稀硫酸反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的试剂错误.
故答案为:
B、Fe和Zn均能与稀硫酸反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的试剂错误.
故答案为:
| 选项 | 待提纯的物质 | 选用的试剂 | 评价 | |
| 是否可行 | 简述理由 | |||
| A | NaCl(Na2CO3) | 盐酸 | 可行 | 除去碳酸钠的同时,增加了氯化钠,且没有引入新的杂质 |
| B | Fe(Zn) | 稀硫酸 | 不可行 | 稀硫酸虽然能除去锌,也能除去铁 |
点评:物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.

练习册系列答案
相关题目
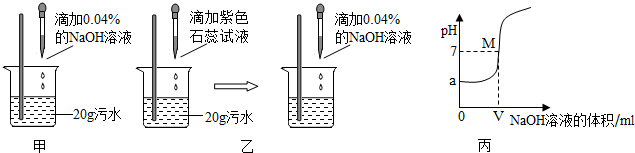
 2H2↑+O2↑
2H2↑+O2↑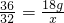
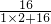 ×100%=88.89%
×100%=88.89% 2H2O+O2↑)能产生多少克氧气?”一题,你认为也能用上述两种方法解答吗?试试看,请把能用的解法过程写出来.
2H2O+O2↑)能产生多少克氧气?”一题,你认为也能用上述两种方法解答吗?试试看,请把能用的解法过程写出来. 2H2↑+O2↑
2H2↑+O2↑
 ×100%=88.89%
×100%=88.89% 2H2O+O2↑)能产生多少克氧气?”一题,你认为也能用上述两种方法解答吗?试试看,请把能用的解法过程写出来.
2H2O+O2↑)能产生多少克氧气?”一题,你认为也能用上述两种方法解答吗?试试看,请把能用的解法过程写出来.