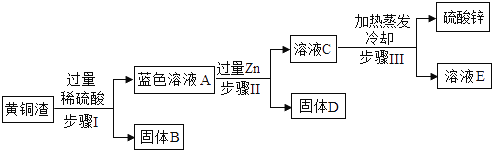
题目内容
【题目】实验室中,利用下列装置可以制取某些气体。请回答下列问题。
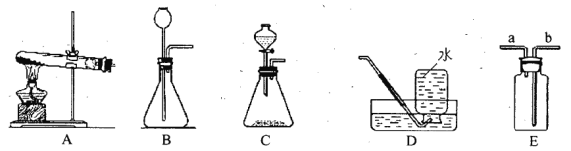
(1)实验室制取CO2的化学方程式为_________。若用E装置收集,则进气管是________(填 “a”或“b”)。(2)若选用装置C和D组合制取并收集O2,反应的化学方程式为_________________,该反应__________________(填“吸收”或“放出”)热量。若锥形瓶内反应过于剧烈,可采取的方法有________________(任写一种)。
(3)查阅资料可知,高铁酸钾(K2FeO4)固体可用于制取氧气。
方案一: 4K2FeO4 ![]() 2Fe2O3+4K2O+3O2
2Fe2O3+4K2O+3O2![]()
方案二: 4K2FeO4+10H2O===4Fe(OH)3![]() +8KOH+3O2
+8KOH+3O2![]()
Ⅰ.若用方案一制取氧气,应该选用的发生装置是___________(选填装置序号)。
Ⅱ.下列关于以上两种方案制取氧气的说法正确的是___________(选填数字序号)。
①方案一发生的是分解反应
②方案二更简便、节能
③制取等质量的氧气,两种方案所需高铁酸钾的质量相等
【答案】CaCO3+2HCl=CaCl2+H2O+CO2↑ b 2H2O2![]() 2H2O+O2↑ 放热 减小滴加液体的速率或者将过氧化氢溶液加水稀释 A ①②③
2H2O+O2↑ 放热 减小滴加液体的速率或者将过氧化氢溶液加水稀释 A ①②③
【解析】
(1)实验室常用石灰石和稀盐酸反应制取CO2,原理是碳酸钙和稀盐酸反应生成二氧化碳、氯化钙、水,化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;若用E装置收集,由于二氧化碳的密度比空气的大,则进气管是b;
(2)过氧化氢法制氧气常选用装置C和D组合,过氧化氢在二氧化锰的作用下分解生成水和氧气,反应的化学方程式为2H2O2![]() 2H2O+O2↑,该反应放出热量。若锥形瓶内反应过于剧烈,可采取的方法有:控制分液漏斗的活塞,减小滴加液体的速率或者将过氧化氢溶液加水稀释;
2H2O+O2↑,该反应放出热量。若锥形瓶内反应过于剧烈,可采取的方法有:控制分液漏斗的活塞,减小滴加液体的速率或者将过氧化氢溶液加水稀释;
(3)由题中信息可知:方案一:4K2FeO4![]() 2Fe2O3+4K2O+3O2
2Fe2O3+4K2O+3O2![]()
方案二:4K2FeO4+10H2O===4Fe(OH)3![]() +8KOH+3O2
+8KOH+3O2![]()
Ⅰ.方案一是加热固体制取氧气,应该选用的发生装置是固-固加热型A;
Ⅱ.①方案一发生的是由一种物质生成多种物质的分解反应;
②方案二不需要加热,更简便、节能
③由化学方程式可知,两种设计方案涉及到的高铁酸钾和氧气的质量比相同,制取等质量的氧气,两种方案所需高铁酸钾的质量相等。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】初三化学学习小组开展以下探究。(1)实验室制取常见气体
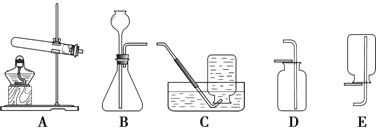
①用高锰酸钾制取氧气可用_____(填标号,下同),用双氧水制取氧气可用______,制取二氧化碳气体可用_____。
a.AC组合 b.BD组合 c.BE组合
②如图所示是方方同学利用报废试管设计的制二氧化碳的发生装置,装置中反应的化学方程式为____。该设计除了废物利用的优点外,请另写一个优点:______。
(2)同学们设计以下实验方案对“影响金属与盐酸反应剧烈程度的因素”进行了探究(盐酸的质量相同且足以把金属完全消耗)。
实验编号 | 金属 | 盐酸的质量分数/% | 温度/℃ | 金属丝消失的时间/s |
1 | 铝丝 | 5 | 20 | 450 |
2 | 铝丝 | 8 | 20 | t |
3 | 铝丝 | 10 | 20 | 240 |
4 | 铝丝 | 10 | 30 | 65 |
5 | 铁丝 | 10 | 30 | 125 |
①上表中还要注明控制的变量是_______。
②铝与盐酸反应的化学方程式为_______。
③实验1、2、3的目的是_____;在实验2中,铝丝消失的时间(用t表示)的取值范围是_____。
④为了比较盐酸与金属反应的剧烈程度,除了用金属丝消失的时间作为观测指标外,还可以选择___。
⑤由实验_____(填实验编号)可知,温度对金属与酸反应速率的影响是____。
⑥实验4、5说明金属与盐酸反应剧烈程度与金属的种类有关,通过这两个实验可知铝的活泼性比铁____(填“强”或“弱”)。