题目内容
下列变化不属于缓慢氧化的是( )
A.醋的酿造 B.蜡烛燃烧 C.动植物呼吸 D.食物腐烂
 阅读快车系列答案
阅读快车系列答案某化学实验小组在做“从 NaCl 和Na2CO3的混合物中提纯 NaCl”的实验。同学们经过讨论认为利用两物质化学性质的差异,可采用如下化学方法来提纯。

(1)如图 X 的化学式为_______________。由于BaCl2溶液的用量不易控制,会使溶液 b 的溶质有多种情况,导致蒸发后得到的固体可能不纯。
(2)实验结束后同学们对溶液 b 的溶质成分进行探究。
(作出猜想)猜想一:NaCl、BaCl2
猜想二:NaCl
猜想三:___________________。
(设计方案)经讨论,大家认为只用一种试剂就能作出判断.
实验步骤 | 实验现象 | 实验结论 |
取少量溶液 b 于试管中,向其中加入_____________。 | 若_______ | 猜想一正确 |
若_______ | 猜想二正确 | |
若_______ | 猜想三正确 |
各组依据上述设计方案进行了实验,验证了反应后溶质的确有三种情况。
(3)(反思评价)大家认为用物理方法和化学方法都可以实现物质的提纯。用化学方法提纯还要考虑到______对提纯效果的影响。
(4)(拓展提升)老师说:“合理选择试剂,用化学方法可以从 NaCl 和Na2CO3的混合物中提纯NaCl,方法是向混合物中加入过量的_____________,充分反应后,经蒸发结晶就能得到 NaCl。
下列离子在水中能大量共存,并形成无色溶液的是 ( )
A.SO42-、Fe2+、Na+、Al3+
B.NH4+、OH-、NO3-、H+
C.HCO3-、K+、Ca2+、Na+
D.Cl-、K+、OH-、Ag+
某化学兴趣小组的同学在做氢氧化钙与盐酸中和反应的实验时,忘记滴加指示剂,因而无法判断酸碱是否恰好完全反应。于是他们对反应后溶液中的溶质大胆提出猜想,进行了以下探究,请你和他们一起完成下列实验报告。
(提出问题)该溶液中的溶质含有哪些成分?
(查阅资料)CaCl2溶液呈中性
(1)(猜想与假设)猜想Ⅰ:溶液中的溶质只有________。
猜想Ⅱ:溶液中的溶质有CaCl2、HCl
猜想Ⅲ:溶液中的溶质有CaCl2、Ca(OH)2
猜想Ⅳ:溶液中的溶质有CaCl2、Ca(OH)2、HCl
(2)请写出该反应的化学方程式________________________。经过讨论,同学们直接得出猜想______是不正确的。为了验证余下的哪一种猜想是正确的,同学们又做了以下实验。
(3)(进行实验)
实验操作 | 实验现象 | 实验结论 |
①取少量反应后的溶液于试管中,滴加酚酞溶液 |
|
|
②再另取少量反应后的溶液于另一支试管中,向里面加入适量碳酸钙 |
| 猜想______不正确 |
(4)有气泡生成的化学方程式为________________________。
(5)(拓展)还可以单独用下列哪种物质来证明上述猜想是正确的________。
A.CuO B.AgNO3 C.Cu D.NaOH
反应的化学方程式为__________________________。


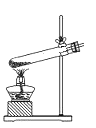 制氧气 B.
制氧气 B.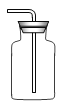 收集氧气
收集氧气 铁丝燃烧 D.
铁丝燃烧 D.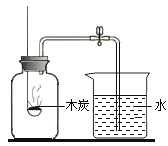 测定空气中氧气的体积分数
测定空气中氧气的体积分数