题目内容
【题目】氢氧化钠是一种重要的化工原料,也是实验室中常见的一种试剂,氢氧化钠必须密封保存,因为易与空气中二氧化碳发生化学反应而变质,用化学方程式表示变质原因 ① 。
下面是几位同学对一瓶氢氧化钠固体成分进行的探究:
探究一:确定一瓶氢氧化钠固体是否变质
小强方案:
实验操作 | 实验现象 | 结论 |
取少量样品于试管中,加入一定量水,样品全溶解后,滴加足量的 ② (填一种溶液名称) | 有气泡产生 | ③ |
探究二:确定氢氧化钠固体变质的程度
小刚方案:
实验操作 | 实验现象 | 结论 |
①取少量样品于试管中,加入一定量水后,样品全溶解后,滴加过量的CaCl2溶液 | 产生白色沉淀 | 氢氧化钠固体部分 变质 |
②静置后取上层清液于试管中,滴入2滴酚酞试液 | ④ |
小刚实验方案中滴入过量的CaCl2溶液目的是 ⑤
探究三:定量分析部分变质的氢氧化钠固体中氢氧化钠的含量
1、下面是小明和小军两位同学不同的设计实验方案:
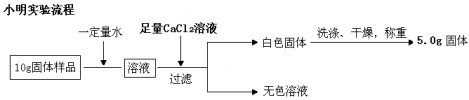
通过小明实验方案计算出样品中氢氧化钠的含量(写出计算过程)
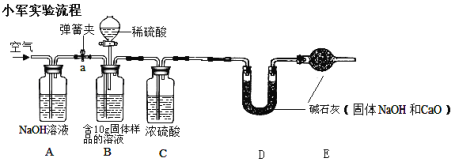
2、小军实验步骤如下
①检查好装置气密性,装好药品后连接并固定好装置
②打开弹簧夹a,通入一段时间的空气,再称量D装置质量记录为100g
③关闭弹簧夹a,打开B装置中的分液漏斗,滴入稀硫酸,直到瓶内无气泡产生。
④打开弹簧夹a, 继续通入一段时间空气,再称量D装置质量记录为102.2g
……
实验分析:
(1)在小军实验中A装置作用是 ,
(2)实验步骤④中,继续通入一段时间空气的目的是 ,
(3)如果缺装置C,最终所测得氢氧化钠的含量将会 (填“偏高”、“不变” 、或者“偏低”)
【答案】2NaOH+CO2=Na2CO3+H2O 小强方案:稀盐酸(稀硫酸) 氢氧化钠固体已变质;小刚方案:溶液变红色 全部除去溶液中的Na2CO3;47%(1)除去空气中的CO2,防止其被D吸收(2) 将反应生成的CO2全部排出被D吸收(3) 偏低
【解析】
试题分析:氢氧化钠必须密封保存,因为易与空气中二氧化碳发生化学反应而变质,用化学方程式表示变质原因2NaOH + CO2 = Na2CO3 + H2O;取少量样品于试管中,加入一定量水,样品全溶解后,滴加足量的盐酸,如果酉气泡冒出,说明存在碳酸钠,因此说明氢氧化钠已经变质;取少量样品于试管中,加入一定量水后,样品全溶解后,滴加过量的CaCl2溶液,得到白色沉淀,说明存在碳酸钠,同时排除碳酸钠的碱性干扰,静置后取上层清液于试管中,滴入2滴酚酞试液,如果试液变红色,说明物质中还有氢氧化钠,从而说明氢氧化钠是部分变质,过程中实验方案滴入过量的CaCl2溶液目的是全部除去溶液中的Na2CO3;设如果产生碳酸钙的质量为5克,则需要碳酸钠的质量分数为X。
CaCl2+ Na2CO3===2NaCl +CaCO3↓
106 100
10.X 克 5克
列比例式得:106:10.X=100:5克
解得X=53%,则含有的氢氧化钠的质量分数=100%-53%=47%。在小军实验中A装置作用是除去空气中的CO2,防止其被D吸收,实验步骤④中,继续通入一段时间空气的目的是将反应生成的CO2全部排出被D吸收,如果缺装置C,最终所测得氢氧化钠的含量将会偏低,因为过程中产生的水分会被D装置吸收,使得二氧化碳的质量增大,得到的碳酸钠的质量就会增大。

 阅读快车系列答案
阅读快车系列答案