题目内容
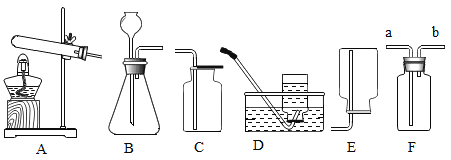
【题目】下图是实验室制取气体的常用装置。
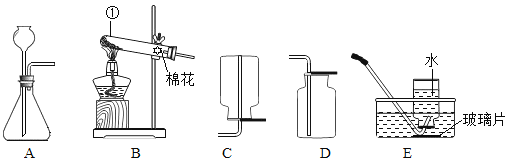
(1)仪器①的名称是_____;
(2)实验室用大理石和稀盐酸反应制取CO2,反应的化学方程式为____,其发生装置可选用上图中的_____(填装置字母),常用的收集装置可选用______;
(3)检验CO2是否收集满的操作是____;
(4)实验室常用澄清石灰水检验二氧化碳,反应化学方程式___
(5)要制取4.4g二氧化碳,理论上需要碳酸钙的质量为____g;
【答案】试管 CaCO3 + 2HCl=CaCl2 + H2O + CO2↑ A D 将燃着的木条放在集气瓶口,木条熄灭,证明已收集满 CO2+Ca(OH)2=CaCO3↓+H2O 10
【解析】
(1)仪器①是试管,故填:试管;
(2)碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,反应物是固体和液体,反应不需要加热,发生装置选择A;二氧化碳气体比空气的密度大,且能溶于水,收集装置选择D.故填:CaCO3+2HCl═CaCl2+CO2↑+H2O;A;D;
(3)检验CO2是否收集满的操作是将燃着的木条放在集气瓶口,木条熄灭,证明已收集满;故填:将燃着的木条放在集气瓶口,木条熄灭,证明已收集满;
(4)二氧化碳一般用澄清的石灰水检验:把气体通入澄清的石灰水中,石灰水变浑浊,就证明是二氧化碳;故填:CO2+Ca(OH)2=CaCO3↓+H2O;
(5)要制取4.4g二氧化碳,设理论上需要碳酸钙的质量为x
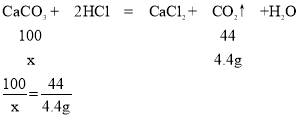
x=10g
故填:10。

练习册系列答案
相关题目