题目内容
在化学反应中,有元素的化合价发生变化的反应就是氧化还原反应.例:2Na+Cl2═2NaCl,反应前后,Na、Cl的化合价发生了变化,该反应是氧化还原反应.
(1)根据化合价是否变化分析,下列反应属于氧化还原反应的是(填序号) .
A.2Mg+O2
 2MgO B.CaO+H2O═Ca(OH)2
2MgO B.CaO+H2O═Ca(OH)2C.2KClO3
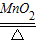 2KCl+3O2↑ D.CaCO3
2KCl+3O2↑ D.CaCO3 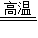 CaO+CO2↑
CaO+CO2↑E.H2+CuO
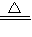 Cu+H2O F.HCl+NaOH═NaCl+H2O
Cu+H2O F.HCl+NaOH═NaCl+H2O(2)含有高价态的化合物,通常具有氧化性,如在氯化铁溶液中,氯化铁能将单质铜氧化成氯化铜,自身被还原成氯化亚铁.该反应的化学方程式可表示为 .
【答案】分析:(1)利用题中信息来分析化学反应中是否有元素化合价的变化,若有元素化合价的变化则属于氧化还原反应;
(2)根据反应物和生成物来书写化学反应方程式.
解答:解:(1)在A中Mg元素的化合价从0升高为+2价,O元素的化合价从0降为-2价;
C中Cl元素的化合价从+5降为-1价,O元素的化合价从-2价升高为0;
E中H元素的化合价从0升高为+1价,Cu元素的化合价从+2价降为0;
而B、D、F中各元素的化合价都没有发生变化,则A、C、E属于氧化还原反应,
故答案为:A、C、E;
(2)根据氯化铁能将单质铜氧化成氯化铜,自身被还原成氯化亚铁,
则反应物为氯化铁和铜,生成物为氯化铜和氯化亚铁,
即反应方程式为2FeCl3+Cu═CuCl2+2FeCl2,
故答案为:2FeCl3+Cu═CuCl2+2FeCl2.
点评:本题考查反应类型的判定及化学反应的书写,学生应注重利用习题中信息来判断反应类型是解答的关键.
(2)根据反应物和生成物来书写化学反应方程式.
解答:解:(1)在A中Mg元素的化合价从0升高为+2价,O元素的化合价从0降为-2价;
C中Cl元素的化合价从+5降为-1价,O元素的化合价从-2价升高为0;
E中H元素的化合价从0升高为+1价,Cu元素的化合价从+2价降为0;
而B、D、F中各元素的化合价都没有发生变化,则A、C、E属于氧化还原反应,
故答案为:A、C、E;
(2)根据氯化铁能将单质铜氧化成氯化铜,自身被还原成氯化亚铁,
则反应物为氯化铁和铜,生成物为氯化铜和氯化亚铁,
即反应方程式为2FeCl3+Cu═CuCl2+2FeCl2,
故答案为:2FeCl3+Cu═CuCl2+2FeCl2.
点评:本题考查反应类型的判定及化学反应的书写,学生应注重利用习题中信息来判断反应类型是解答的关键.

练习册系列答案
相关题目
(4分)在化学反应中,有元素的化合价发生变化的反应就是氧化还原反应。例: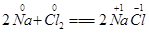 ,反应前后,Na、Cl的化合价发生了变化,该反应是氧化还原反应。(1)根据化合价是否变化分析,下列反应属于氧化还原反应的是(填序号)_________。
,反应前后,Na、Cl的化合价发生了变化,该反应是氧化还原反应。(1)根据化合价是否变化分析,下列反应属于氧化还原反应的是(填序号)_________。
A.2Mg+O2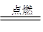 2MgO 2MgO | B.CaO+H2O ="==" Ca(OH)2 |
C.2KClO3 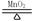 2KCl+3O2↑ 2KCl+3O2↑ | D.CaCO3 CaO + CO2↑ CaO + CO2↑ |
 Cu + H2O F.HCl + NaOH="==NaCl" + H2O
Cu + H2O F.HCl + NaOH="==NaCl" + H2O(2)含有高价态的化合物,通常具有氧化性,如在氯化铁溶液中,氯化铁能将单质铜氧化成氯化铜,自身被还原成氯化亚铁。该反应的化学方程式可表示为____________________。
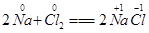 ,反应前后,Na、Cl的化合价发生了变化,该反应是氧化还原反应。(1)根据化合价是否变化分析,下列反应属于氧化还原反应的是(填序号)_________。
,反应前后,Na、Cl的化合价发生了变化,该反应是氧化还原反应。(1)根据化合价是否变化分析,下列反应属于氧化还原反应的是(填序号)_________。 2MgO B.CaO+H2O═Ca(OH)2
2MgO B.CaO+H2O═Ca(OH)2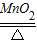 2KCl+3O2↑ D.CaCO3
2KCl+3O2↑ D.CaCO3 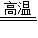 CaO+CO2↑
CaO+CO2↑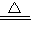 Cu+H2O F.HCl+NaOH═NaCl+H2O
Cu+H2O F.HCl+NaOH═NaCl+H2O