题目内容
| 一 | I A | II A | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | 3 Li 锂 6.941 |
4 Be 铍 9.012 |
5 B 硼 10.81 |
6 C 碳 12.01 |
7 N 氮 14.01 |
8 O 氧 16.00 |
9 F 氟 19.00 |
10 Ne 氖 20.18 |
| 三 | 11 Na 钠 22.99 |
12 Mg 镁 24.31 |
13 Al 铝 26.98 |
14 Si 硅 28.09 |
15 P 磷 30.97 |
16 S 硫 32.06 |
17 Cl 氯 35.45 |
18 Ar 氩 39.95 |
(2)表中不同种元素最本质的区别是
A.质子数不同 B.相对原子质量不同 C.电子数不同
(3)第12号元素与第17号元素组成化合物的化学式是
(4)上图的排列具有一定的规律,如同一周期中,
(5)在第三周期中,具有相对稳定结构的原子是
(6)下列各组元素具有相似化学性质的是
A.C和Ne B.Be和Mg C.Al和Si D.O和Cl
(7)某粒子的结构示意图为,
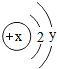 当x-y=5(y≠0)时,该粒子为
当x-y=5(y≠0)时,该粒子为(2)元素是质子数(即核电荷数)相同的一类原子的总称,决定元素种类的是质子数(即核电荷数).
(3)第12号元素与第17号元素分别是镁元素和氯元素,组成化合物是氯化镁,写出其化学式即可.
(4)根据同一周期元素的原子原子序数的变化规律进行分析解答.
(5)最外层具有8个电子的原子具有相对稳定结构.
(6)元素的化学性质跟它的原子的最外层电子数目关系非常密切,同一族(纵行)的元素具有相同的最外层电子数,具有相似的化学性质,据此进行分析解答.
(7)若为原子,则x=y+2,即x-y=2;则当x-y=5>2(y≠0)时,为阳离子,据此进行分析解答.
(2)根据决定元素种类的是核内质子数,不同种元素最本质的区别是核内质子数不同.
(3)第12号元素与第17号元素分别是镁元素和氯元素,组成化合物是氯化镁,其化学式是MgCl2.
(4)同一周期的元素,从左到右,原子序数依次增大.
(5)最外层具有8个电子的原子具有相对稳定结构,表中具有相对稳定结构的元素氩元素,其元素符号为:Ar.
(6)元素的化学性质跟它的原子的最外层电子数目关系非常密切,同一族(纵行)的元素具有相同的最外层电子数,具有相似的化学性质,Be和Mg属于同一族(纵行),化学性质相似.
(7)若为原子,则x=y+2,即x-y=2;则当x-y=5>2(y≠0)时,为阳离子,是失去最外层电子后得到的,y应等于8,则x=8+5=13,为铝离子;其符号为:Al3+.
故答案为:(1)硼元素的原子序数为5等;(2)A;(3)MgCl2;(4)从左到右,原子序数依次增大等;(5)Ar(或氩);(6)B;(7)Al3+.

 阅读快车系列答案
阅读快车系列答案元素周期表是学习和研究化学的重要工具。请根据下表(元素周期表的部分内容)回答有关问题:
|
族
周期 |
I A |
II A |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
|
2 |
3 Li 锂 6.941 |
4 Be 铍 9.012 |
5 B 硼 10.81 |
6 C 炭 12.01 |
7 N 氮 14.01 |
8 O 氧 16.00 |
9 F 氟 19.00 |
10 Ne 氖 20.18 |
|
3 |
11 Na 钠 22.99 |
12 Mg 镁 24.31 |
13 Al 铝 26.98 |
14 Si 硅 28.09 |
15 P 磷 30.97 |
16 S 硫 32.06 |
17 Cl 氯 35.45 |
18 Ar 氩 39.95 |
(1)请从上表中查出关于硼元素的一条信息:___________________________。
(2)请从上表中找出一种元素名称是错误的,更正为 .
(3)第3周期(横行)中属于金属元素的是 (填一种元素符号),其阳离子是 。
(4)在金属活泼性中,镁元素比铝元素活泼,请你从原子结构的观念进行解释 。
(5)第9号氟元素和氢元素形成的化合物的水溶液氢氟酸(HF),可用于玻璃雕刻, 其主要原理是氢氟酸与玻璃的主要成分二氧化硅(SiO2)发生反应,生成四氟化硅气体(SiF4)和水,该反应的化学方程式为 。
元素周期表是学习和研究化学的重要工具。请根据下表(元素周期表的部分内容)回答有关问题:
|
|
I A |
II A |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
|
2 |
3 Li 锂 6.941 |
4 Be 铍 9.012 |
5 B 硼 10.81 |
6 C 碳 12.01 |
7 N 氮 14.01 |
8 O 氧 16.00 |
9 F 氟 19.00 |
10 Ne 氖 20.18 |
|
3 |
11 Na 钠 22.99 |
12 Mg 镁 24.31 |
13 Al 铝 26.98 |
14 Si 硅 28.09 |
15 P 磷 30.97 |
16 S 硫 32.06 |
17 Cl 氯 35.45 |
18 Ar 氩 39.95 |
(1)请从上表中查出关于硼元素的一条信息: 。
(2)第3周期中相对原子质量最大的金属元素的是 。
(3)在元素周期表中,同一族(纵行)的元素具有相似的化学性质。则下列各组元素具有相似化学性质的是 (填标号)。
a.C和Ne b.Be和Mg c.Al和Si d.F和Cl
(4)第9号氟元素和氢元素形成的化合物的水溶液氢氟酸(HF),可用于玻璃雕刻,其主要原理是氢氟酸与玻璃的主要成分二氧化硅(SiO2)发生反应,生成四氟化硅气体和水,该反应的化学方程式为 。