题目内容
(2013?崇明县二模)某碳酸钠样品中含有少量氯化钠杂质,为测定该样品中碳酸钠的质量分数,进行了如下实验:
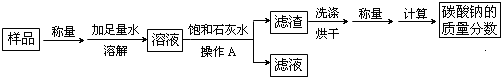
①实验一:
请回答下列问题:
(Ⅰ)操作A中用到玻璃棒,其作用是
(Ⅱ)甲同学取少量(碳酸钠样品)溶液,滴入无色酚酞试液,溶液由无色变成
(Ⅲ)在实验过程中加入饱和石灰水后发生反应的化学方程式是
(Ⅳ)为探究上述反应后滤液中的溶质成分,乙同学向滤液中滴加过量稀盐酸,发现
有气泡产生,则滴加盐酸前滤液中的溶质除氯化钠外还有
②实验二:
丙同学取12g该碳酸钠样品放入烧杯中,加入100g稀盐酸(足量),完全反应后,所
得溶液质量为107.6g.试计算:
(Ⅰ)生成二氧化碳物质的量为
(Ⅱ)碳酸钠样品中Na2CO3的质量分数.(写出计算过程,保留到0.1%)
(Ⅲ)如果测得的结果比实际的质量分数高,可能的原因是

①实验一:
请回答下列问题:
(Ⅰ)操作A中用到玻璃棒,其作用是
引流
引流
.(Ⅱ)甲同学取少量(碳酸钠样品)溶液,滴入无色酚酞试液,溶液由无色变成
红色
红色
.(Ⅲ)在实验过程中加入饱和石灰水后发生反应的化学方程式是
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
.(Ⅳ)为探究上述反应后滤液中的溶质成分,乙同学向滤液中滴加过量稀盐酸,发现
有气泡产生,则滴加盐酸前滤液中的溶质除氯化钠外还有
碳酸钠、氢氧化钠
碳酸钠、氢氧化钠
.②实验二:
丙同学取12g该碳酸钠样品放入烧杯中,加入100g稀盐酸(足量),完全反应后,所
得溶液质量为107.6g.试计算:
(Ⅰ)生成二氧化碳物质的量为
0.1
0.1
mol.(Ⅱ)碳酸钠样品中Na2CO3的质量分数.(写出计算过程,保留到0.1%)
88.3%
88.3%
.(Ⅲ)如果测得的结果比实际的质量分数高,可能的原因是
稀盐酸挥发出的HCl气体随CO2气体排出,从而导致所测样品中碳酸钠的质量分数偏大
稀盐酸挥发出的HCl气体随CO2气体排出,从而导致所测样品中碳酸钠的质量分数偏大
.(答一种即可)分析:①(Ⅰ)根据过滤中玻璃棒的作用分析;
(Ⅱ)根据无色酚酞遇碱变红进行分析;
(Ⅲ)碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,并结合方程式的书写方法书写方程式;
(Ⅳ)根据反应流程图分析滤液中有碳酸钠和氢氧化钙反应生成的氢氧化钠;滴加过量稀盐酸,发现有气泡产生,说明碳酸钠溶液过量,该滤液中还含有碳酸钠;
②(Ⅰ)根据质量守恒定律分析;
(Ⅱ)根据化学方程式Na2CO3+2HCl═2NaCl+H2O+CO2↑和生成二氧化碳的质量可以计算出碳酸钠样品中Na2CO3的质量,从而计算出碳酸钠的质量分数;
(Ⅲ)稀盐酸挥发出的HCl气体或水蒸气随CO2气体排出,从而导致所测样品中碳酸钠的质量分数偏大.
(Ⅱ)根据无色酚酞遇碱变红进行分析;
(Ⅲ)碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,并结合方程式的书写方法书写方程式;
(Ⅳ)根据反应流程图分析滤液中有碳酸钠和氢氧化钙反应生成的氢氧化钠;滴加过量稀盐酸,发现有气泡产生,说明碳酸钠溶液过量,该滤液中还含有碳酸钠;
②(Ⅰ)根据质量守恒定律分析;
(Ⅱ)根据化学方程式Na2CO3+2HCl═2NaCl+H2O+CO2↑和生成二氧化碳的质量可以计算出碳酸钠样品中Na2CO3的质量,从而计算出碳酸钠的质量分数;
(Ⅲ)稀盐酸挥发出的HCl气体或水蒸气随CO2气体排出,从而导致所测样品中碳酸钠的质量分数偏大.
解答:解:①(Ⅰ)操作A是过滤,其中玻璃棒的作用是引流,故答案为:引流;
(Ⅱ)碳酸钠溶液显碱性,滴入无色酚酞试液,溶液由无色变成红色;故答案为:红色;
(Ⅲ)样品中的氯化钠与氢氧化钙不反应,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,方程式是Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
故答案为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
(Ⅳ)滤液中有碳酸钠和氢氧化钙反应生成的氢氧化钠;另外滴加过量稀盐酸,发现有气泡产生,说明碳酸钠溶液过量,所以该滤液中还含有碳酸钠;
故答案为:碳酸钠、氢氧化钠;
②(Ⅰ)根据质量守恒定律可知,生成二氧化碳物质的质量为12g+100g-107.6g=4.4g.二氧化碳的摩尔质量是44g/mol,因此生成二氧化碳物质的量为
=0.1mol;故答案为:0.1;
(Ⅱ)设碳酸钠样品中Na2CO3的质量的质量为x,则
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x 4.4g
=
解得x=10.6g
则样品中碳酸钠的质量分数为:
×100%=88.3%;
故答案为:88.3%;
(Ⅲ) 稀盐酸挥发出的HCl气体随CO2气体排出,从而导致所测样品中碳酸钠的质量分数偏大;故答案为:稀盐酸挥发出的HCl气体随CO2气体排出,从而导致所测样品中碳酸钠的质量分数偏大.
(Ⅱ)碳酸钠溶液显碱性,滴入无色酚酞试液,溶液由无色变成红色;故答案为:红色;
(Ⅲ)样品中的氯化钠与氢氧化钙不反应,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,方程式是Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
故答案为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
(Ⅳ)滤液中有碳酸钠和氢氧化钙反应生成的氢氧化钠;另外滴加过量稀盐酸,发现有气泡产生,说明碳酸钠溶液过量,所以该滤液中还含有碳酸钠;
故答案为:碳酸钠、氢氧化钠;
②(Ⅰ)根据质量守恒定律可知,生成二氧化碳物质的质量为12g+100g-107.6g=4.4g.二氧化碳的摩尔质量是44g/mol,因此生成二氧化碳物质的量为
| 4.4g |
| 44g/mol |
(Ⅱ)设碳酸钠样品中Na2CO3的质量的质量为x,则
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x 4.4g
| 106 |
| 44 |
| x |
| 4.4g |
解得x=10.6g
则样品中碳酸钠的质量分数为:
| 10.6g |
| 12g |
故答案为:88.3%;
(Ⅲ) 稀盐酸挥发出的HCl气体随CO2气体排出,从而导致所测样品中碳酸钠的质量分数偏大;故答案为:稀盐酸挥发出的HCl气体随CO2气体排出,从而导致所测样品中碳酸钠的质量分数偏大.
点评:本题考查了学生分析和解决问题的能力,明确每一步的作用和所发生的化学反应,同时要理解和熟记根据化学反应方程式的计算步骤、格式以及与之相关的知识等,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目