题目内容
(2011?密云县一模)物质都是由粒子构成的,化学反应的实质是粒子之间的重新组合.(1)如图为甲、乙两种不同的气态物质在一定条件下反应生成丙物质的微观示意图,其中
 和
和 分别表示氢原子和氮原子,则可知:
分别表示氢原子和氮原子,则可知: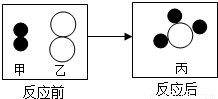
①一个丙分子由个原子构成.
②构成甲物质的粒子是(填“分子”、“原子”或“离子”).
③此反应中甲、乙、丙三种物质的粒子个数比为.
(2)把一定质量的纯净物A和80g B在一定条件下按如图所示充分反应,当B消耗完时,可生成88gD物质和18gE物质.
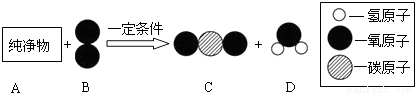
请回答下列问题:
①参加反应的A物质的质量是.
②A分子中各元素的原子个数比是(需表示出元素种类).
【答案】分析:(1)①根据微观示意图即可看出一个丙分子由几个原子构成;
②根据分子、原子、离子的概念解答.原子指化学反应的基本微粒,原子在化学反应中不可分割.分子是独立存在而保持物质化学性质的最小粒子,分子可以构成物质,分子在化学变化中还可以被分成更小的微粒.在化学变化中,电中性的原子经常会得到或者失去电子而成为带电荷的微粒,这种带电的微粒叫做离子.
③根据微观示意图和质量守恒定律,写出反应的化学方程式,就可得出此反应中甲、乙、丙三种物质的粒子个数比;
(2)①根据质量守恒定律,A物质的质量=D物质质量+E物质质量-B物质质量;
②根据D物质质量和其中C的质量分数,计算出A物质中含有C的质量,根据E物质质量和其中氢的质量分数,计算出A物质中含有H的质量,A物质质量-含有C的质量-含有H的质量=含有O的质量,然后根据元素的质量比和相对原子质量,求出个数比.
解答:解:(1)①根据微观示意图即可看出一个丙分子由4个原子构成;
②由微观示意图可知,甲物质由2个氢原子构成的分子;
③根据质量守恒定律可知,此反应的化学方程式为:3H2+N2=2NH3,则此反应中甲、乙、丙三种物质的粒子个数比为:3:1:2;
(2)①根据质量守恒定律,A物质的质量=88g+18g-80g=26g;
②A物质中C元素的质量为:88g×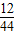 =24g;
=24g;
A物质中H元素的质量为:18g×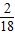 =2g;
=2g;
A物质中O元素的质量为:26g-24g-2g=0.故A物质中只有C、H两种元素,C的质量:H的质量=24g:2g=12:1,因为C的相当于增长率为12,氢的相对原子质量为2,故C的个数:H的个数=1:1.
点评:本题主要考查学生根据质量守恒定律解答问题的能力.学生需认真分析微粒示意图,才能曾国强解答.
②根据分子、原子、离子的概念解答.原子指化学反应的基本微粒,原子在化学反应中不可分割.分子是独立存在而保持物质化学性质的最小粒子,分子可以构成物质,分子在化学变化中还可以被分成更小的微粒.在化学变化中,电中性的原子经常会得到或者失去电子而成为带电荷的微粒,这种带电的微粒叫做离子.
③根据微观示意图和质量守恒定律,写出反应的化学方程式,就可得出此反应中甲、乙、丙三种物质的粒子个数比;
(2)①根据质量守恒定律,A物质的质量=D物质质量+E物质质量-B物质质量;
②根据D物质质量和其中C的质量分数,计算出A物质中含有C的质量,根据E物质质量和其中氢的质量分数,计算出A物质中含有H的质量,A物质质量-含有C的质量-含有H的质量=含有O的质量,然后根据元素的质量比和相对原子质量,求出个数比.
解答:解:(1)①根据微观示意图即可看出一个丙分子由4个原子构成;
②由微观示意图可知,甲物质由2个氢原子构成的分子;
③根据质量守恒定律可知,此反应的化学方程式为:3H2+N2=2NH3,则此反应中甲、乙、丙三种物质的粒子个数比为:3:1:2;
(2)①根据质量守恒定律,A物质的质量=88g+18g-80g=26g;
②A物质中C元素的质量为:88g×
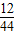 =24g;
=24g;A物质中H元素的质量为:18g×
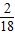 =2g;
=2g;A物质中O元素的质量为:26g-24g-2g=0.故A物质中只有C、H两种元素,C的质量:H的质量=24g:2g=12:1,因为C的相当于增长率为12,氢的相对原子质量为2,故C的个数:H的个数=1:1.
点评:本题主要考查学生根据质量守恒定律解答问题的能力.学生需认真分析微粒示意图,才能曾国强解答.

练习册系列答案
相关题目