题目内容
将含有氯化钾的氢氧化钾样品2.5g放入12.9g水中完全溶解,在加入14.6g10%的盐酸恰好中和.计算:(1)样品中氢氧化钾的质量分数.
(2)反应后所得溶液中溶质的质量分数.
【答案】分析:(1)根据酸碱中和的反应化学方程式进行,计算时要根据盐酸的质量求出氢氧化钾的质量以及氢氧化钾的质量分数;
(2)根据反应化学方程式计算出氯化钾的质量,再加上原来氯化钾的质量从而求出反应后所得溶液中溶质的质量分数.
解答:解:(1)设样品中氢氧化钾的质量为x
KOH+HCl═KCl+H2O
56 36.5
x 14.6g10%
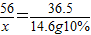
x=2.24g
则样品中氢氧化钾的质量分数为: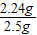 ×100%=89.6%;
×100%=89.6%;
(2)设生成氯化钾的质量为y
KOH+HCl═KCl+H 2O
36.5 74.5
14.6g10% y
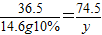
y=2.98g
反应后所得溶液中溶质的质量分数=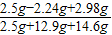 ×100%=10.8%
×100%=10.8%
故答案为:(1)89.6%;(2)10.8%.
点评:本题考查了酸碱之间的中和反应以及溶液中溶质质量分数的有关计算,完成此题,可以依据反应的化学方程式进行.
(2)根据反应化学方程式计算出氯化钾的质量,再加上原来氯化钾的质量从而求出反应后所得溶液中溶质的质量分数.
解答:解:(1)设样品中氢氧化钾的质量为x
KOH+HCl═KCl+H2O
56 36.5
x 14.6g10%
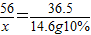
x=2.24g
则样品中氢氧化钾的质量分数为:
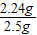 ×100%=89.6%;
×100%=89.6%;(2)设生成氯化钾的质量为y
KOH+HCl═KCl+H 2O
36.5 74.5
14.6g10% y
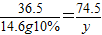
y=2.98g
反应后所得溶液中溶质的质量分数=
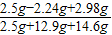 ×100%=10.8%
×100%=10.8%故答案为:(1)89.6%;(2)10.8%.
点评:本题考查了酸碱之间的中和反应以及溶液中溶质质量分数的有关计算,完成此题,可以依据反应的化学方程式进行.

练习册系列答案
相关题目