题目内容
【题目】某化学兴趣小组在实验室配制一定溶质质量分数的稀盐酸,并用其测定某氢氧化钠溶液的溶质质量分数.

(1)配制74g质量分数为10%的稀盐酸,需要质量分数为37%的浓盐酸(密度为1.18g/cm3)
mL (计算结果保留一位小数),加水 mL.在实验室用浓盐酸配制稀盐酸的主要步骤有:计算、 、混匀、装瓶并贴上标签.
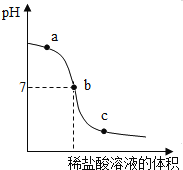
(2)用上述配制的稀盐酸加入到20g某氢氧化钠溶液中,溶液pH的变化情况如下图所示.
①根据曲线判断,当加入稀盐酸的质量为 时,反应恰好完全进行.
②当加入20g稀盐酸时,所得溶液中的离子有 (填化学符号).
③试计算该氢氧化钠溶液中溶质的质量分数.(请写出计算过程)
【答案】(1)16.9;54;量取;(2)①36.5g; ②Na+、Cl﹣、OH﹣;③20%
【解析】(1)根据配制前后溶液中的溶质质量不变,设需要37%浓盐酸溶液的质量为x,则有:74g×10%=37%×x,解得x=20g,则需要37%浓盐酸溶液的体积为![]() ≈16.9ml,
≈16.9ml,
需要水的质量为74g﹣20g=54g,即需要54mL水,在实验室用浓硫酸配制稀硫酸的主要步骤有:计算、量取浓硫酸和水,然后混匀、冷却至室温装瓶并贴上标签.
(2)①根据温度变化曲线,溶液pH=7时,即为氢氧化钠与盐酸恰好完全反应,即当加入稀盐酸的质量为 36.5g 时,反应恰好完全进行;故答案:36.5g;
②由温度变化曲线可知,当加入20g稀盐酸时,氢氧化钠未完全反应,此时所得溶液为反应生成氯化钠与未完全反应的氢氧化钠的混合溶液;故溶液中溶质为NaOH、NaCl;故所得溶液中的离子有Na+、Cl﹣、OH﹣;
③解:设20g氢氧化钠溶液中溶质的质量为x.
NaOH+HCl=NaCl+H2O
40 36.5
x 36.5g×10%=3.65g
则![]() ,解得x=4g,故
,解得x=4g,故![]() ×100%=20%
×100%=20%
答:该氢氧化钠溶液中溶质的质量分数为20%

【题目】【2016年黑龙江省绥化市】部分食物和体液的近似pH如表所示.下列说法中正确的是( )
食物和体液 | 胃液 | 苹果汁 | 牛奶 | 血浆 |
pH | 0.9~1.5 | 2.9~3.3 | 6.3~6.6 | 7.4~7.5 |
A.血浆和牛奶显碱性 B.胃液和苹果汁显酸性
C.胃液比苹果汁酸性弱 D.胃酸过多的人应多饮苹果汁