题目内容
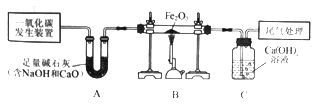
【题目】侯德榜是我国著名的化学家,发明了侯氏制碱法,为纯碱和氮肥工业技术的发展作出了杰出的贡献。工业上以半水煤气(主要成分是N2、H2、CO、CO2和H2O)、食盐等为原料制取纯碱的流程如下:



(1)流程中循环利用的物质有H2O和_____。
(2)步骤Ⅰ中,在使用铜催化剂和加热条件下,半水煤气主要成分间发生反应实现了CO转化,化学方程式是_____。
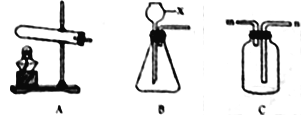
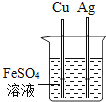
(3)实验室从混合气体H2、N2、CO2中分离出CO2的实验装置如图所示。广口瓶和分液瀾斗中盛放的药品分别是_____、_____。
(4)除去纯碱中少量碳酸氢钠杂质的方法是_____。
(5)纯碱用途广泛。工业上可用废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3,达到减少污染、节约资源的目的。反应过程中溶液组成变化如图2所示。
①吸收初期(图中3A点以前)反应的化学方程式为_____。
②不断通入SO2,最终产物是_____。
【答案】 CO2 CO+H2O![]() CO2+H2 氢氧化钠溶液 稀硫酸 加热 2Na2CO3+SO2+H2O=2NaHCO3+Na2SO3 NaHSO3
CO2+H2 氢氧化钠溶液 稀硫酸 加热 2Na2CO3+SO2+H2O=2NaHCO3+Na2SO3 NaHSO3
【解析】(1)由图可知,过程中可以循环利用的物质由水和二氧化碳;
(2)步骤Ⅰ中一氧化碳与水在铜做催化剂的条件下加热生成二氧化碳和氢气,反应方程式为CO+H2O![]() CO2+H2 ;
CO2+H2 ;
(3)混合气体是H2、N2、CO2,可以利用氢氧化钠溶液吸收二氧化碳生成碳酸钠溶液,而后向溶液中加入稀硫酸,与碳酸钠反应生成硫酸钠和二氧化碳气体,故所装药品依次为氢氧化钠溶液和稀硫酸;
(4)碳酸钠受热不易分解,而碳酸氢钠受热易分解,故碳酸钠中混有碳酸氢钠时,可以用加热的方法除去碳酸氢钠;
(5)①吸收初期的反应是碳酸钠和二氧化硫和水反应生成碳酸氢钠和亚硫酸钠,反应方程式为2Na2CO3+SO2+H2O=2NaHCO3+Na2SO3;②不断的通入二氧化硫后最终生成的产物是亚硫酸氢钠;