��Ŀ����
����Ŀ������ijˮ�೧������Ϊ�˲ⶨ����ʯ��ʯ��̼��Ƶ�����������ȡʯ��ʯ��Ʒ������ϡ�������ձ��з�Ӧ��ʯ��ʯ��Ʒ�����ʲ���ϡ���ᷴӦ��Ҳ������ˮ������¼�й��������
��Ӧǰ | ��Ӧ�� | ||
ʵ������ | �ձ���ϡ��������� | ʯ��ʯ��Ʒ������ | �ձ������л��������� |
150�� | 14�� | 159.6�� | |
����㣺
��1���÷�Ӧ�����ɶ�����̼ �ˣ���ֻд�����
��2��̼����и�Ԫ�ص����������� %��ֻд�������
��3����ʯ��ʯ��Ʒ��̼��Ƶ�������������д�������̣������ȷ��0.1%��
���𰸡���1��4.4����2��40����3��71.4%��
����������1�����ɶ�����̼������Ϊ��150g+14g��159.6g=4.4��
��2��̼����и�Ԫ�ص���������Ϊ��![]() ��100%=40%��
��100%=40%��
��3���⣺��ʯ��ʯ��Ʒ��̼��Ƶ���������Ϊx��
CaCO3+2HCl=CaCl2+CO2��+H2O��1�֣�
100 44
14gx 4.4g
![]() =
=![]()
x=0.714=71.4%
�𣺴���ʯ��̼��Ƶ���������Ϊ71.4%��

����Ŀ��ijͬѧ����ijά����C����Ƭ��ˮ�����������ݣ����������Ȥ��������һϵ���о�����֪ά����C����Ƭ�����ϣ�ά����C 2%�����ǡ�̼���εȣ�
ʵ�鲽�� | ʵ������ | ʵ����� |
��ͼ1�����Թ��е��뼸��ˮ��1min������ƿ�� | С�Թ��� ������ʯ��ˮ����ǣ�ע������˨ �� | ������������������������ɣ� |
����������ɷּ�ԭ��
���룺�����к���CO2�������� ��
������������ԭ������Ƭ�к�������������̼���η�Ӧ��
����ʵ�飺��ά����C����Ƭ�ܽ���һ����ˮ���� ������Ӧ�����Һ����Ϊ3��˵����ά����C����Ƭ�����������ʣ�
����ʵ���й�̬����������̼���η�Ӧʱ��ˮ���������ܽ��̬���������γ�����Һ��ʹ֮��̼���η�Ӧ����ˣ������ά����C����ƬӦע�� ��
��̽��������̼Դ��
���룺��ά����C����Ƭ������������Ϊ20%�Ķ�����̼Դ�����Σ����й����ϼ��ض�����̼�����Ǣ�NaHCO3�� ��NaHCO3��Na2CO3�Ļ���
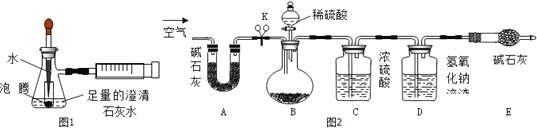
ʵ�飺����ͼ2װ�ã��г������ԣ�����̽����ͼ2��װϡ��������������� ����Ҫʵ�鲽���У��ټ��װ�������ԣ��ڳ�ȡ4.20g����Ƭ��ĩװ����ƿ�У��ɿ����ɼ�K��ͨ��һ��ʱ��������۳���װ��DΪ200.00g�����ϵ��ɼ�K���μ�ϡ������ɿ����ɼ�K����ͨ��һ��ʱ��������ݳ���װ��D����Ϊ200.44g����Ӧ��ʼǰͨ�������Ŀ���� ������ܵ������� ��
���ݴ�����ͨ�������жϳ����ϲ��� ������ţ�������
��˼������
��1��Eװ�õ������� ��
��2����ͬѧ�������Dװ���滻����E��ͬ��װ�ø��Ӻ�����ԭ���� ��
��3�����û��Cװ�ã��Ը�ʵ����û��Ӱ�� ��
