��Ŀ����
����Ŀ����ѧ��ȤС���ͬѧ�ԡ�Ӱ����������ᷴӦ�ľ��ҳ̶ȵ����ء�������̽����
[�������]���������ᷴӦ���ҳ̶�����Щ���ص�Ӱ��?
[��������]a����������������������й� b�������������Ũ���й�
[���̽��]ʵ�����ý���������ɰֽ��ĥ
��1��ʵ���Ϊ̽������a��С��ͬѧ�ֱ�����֧�Թ��з�����ͬ������пƬ����Ƭ��Ȼ��ֱ������ͬŨ�ȣ���ͬ������ϡ���ᣬ�۲쵽��пƬ���Թ������������������ݣ�����Ƭ���Թ���ֻ�����������ݣ�����ϡ���ᷴӦ�Ļ�ѧ����ʽΪ__________����ʵ��������жϣ��������Zn_______Fe ���<����=����>������
�ó����ۣ����������ᷢ����Ӧ�ľ��ҳ̶���������������йأ������Ļ���뷴Ӧ�ľ��ҳ̶ȵĹ�ϵ��________��
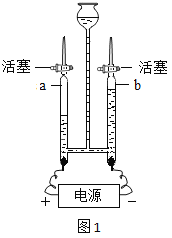
��2��ʵ���Ϊ̽������b��С��ͬѧ�����ͼ��װ�ý���ʵ�飬����ע������������_________��

����ҩƷ��ʵ���������±���
ʵ���� | ѡ�ý�������ȡ2g�� | ����������������ȡ50mL�� | ÿ���Ӳ������������/mL | |||||
1��|�� | 1~2���� | 2~3���� | 3~4���� | 4~5���� | ǰ5���ӹ��ռ����� | |||
�� | пƬ | 15% | 2.9 | 16.9 | 11.0 | 9.2 | 7.6 | 48.5 |
�� | пƬ | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
��3���ó����ۣ����������ᷢ����Ӧ�ľ��ҳ̶��������Ũ���йأ����ϵ��__________��
��4��[��˼����]���ݱ���ʵ��II���ݷ�����п�����ᷢ����Ӧ�����ı仯���Ϊ________����ԭ��Ϊ_______��
��5��ͨ������̽��������Ϊ���������ᷴӦ�ľ��ҳ̶ȿ��ܻ�����Щ���ص�Ӱ��_______��дһ�����ɣ���
���𰸡�Fe+2HCl=FeCl2+H2�� �� �������Խǿ����ӦԽ���� ͨ��ע���������ƶ���������������������� ����������ͬʱ������Ũ��Խ��ӦԽ���ң� �������졢���ɿ쵽�� п��ϡ���ᷴӦ���ȣ����ŷ�Ӧ�Ľ��У��¶����ߣ������ٶ�Խ��Խ�죬һ��ʱ������ᱻ���ģ�����Ũ�ȱ�С����Ӧ���ʼ��� ���������ᷴӦ�ľ��ҳ̶ȿ����ܽ��������Ĵ�С�������Ĵ��ȵ����ص�Ӱ��
��������
��1���������ᷴӦ�����Ȼ���������������Ӧ�Ļ�ѧ����ʽΪ��Fe+2HCl=FeCl2+H2������пƬ���Թ������������������ݣ�����Ƭ���Թ���ֻ�����������ݣ���˽������ǿ��Ϊ��Zn��Fe��
�ó����ۣ����������ᷴӦ�ľ��ҳ̶���������������йأ������Ļ���뷴Ӧ�ľ��ҳ̶ȵĹ�ϵ�ǣ��������Խǿ����ӦԽ���ҡ�
��2����ʵ��װ��ͼ�п�֪��װ���в�������������ע��������ע�����ռ�������Ϊ��ע�����Ͽ��Զ����������������ע�����������ǣ�ͨ��ע���������ƶ�������ж����������������
��3�����ݱ����ṩ�����ݿ�֪������������ͬʱ������Ũ��Խ��ӦԽ���ң�
��4��п�����ᷴӦ����������ٶ��ȼӿ���������Ϊп�������Ƿ��ȷ�Ӧ�����Կ�ʼʱ�¶����ߣ����������ٶȼӿ죬���ŷ�Ӧ�Ľ��У�����ϱ����ģ�Ũ�Ƚ��ͣ����������ٶȱ�����
��5��Ӱ�컯ѧ��Ӧ���ʵ������кܶ࣬���������ᷴӦ�ľ��ҳ̶ȿ����ܽ��������Ĵ�С�������Ĵ��ȵ����ص�Ӱ�죨дһ�����ɣ���

 ȫ�ſ��䵥Ԫ�����������ܸ�ϰϵ�д�
ȫ�ſ��䵥Ԫ�����������ܸ�ϰϵ�д�