题目内容
金属钠是非常活泼的金属,常温下易与氧气、氮气、水等反应.用钠和氮气制得的叠氮钠用于医药、农药等的有机合成,还可用于防酶,血清防腐,污水含氮量测定等.江海实验学校初三兴趣小组利用如下装置(部分固定装置已略去),制备叠氮钠,并探究其化学式.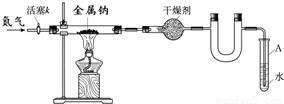
(1)写出钠和氧气反应生成氧化钠的化学方程式______.
(2)按图连接好实验装置.检查装置气密性的方法是______.
(3)干燥装置的作用是______,末端导管必须始终用试管A中的水液封,目的是______.
(4)制备叠氮钠的操作步骤是:①打开活塞k并通入N2;②点燃酒精灯,进行反应;
③反应结束后,______;④拆除装置,取出产物.
(5)数据记录如下:
| 空硬玻璃管质量m/g | 硬玻璃管与钠的质量m1/g | 硬玻璃管与产物的质量m2/g |
| 114.8 | 124 | 140.8 |
②若通入的N2中混有少量O2,如上测得的m2______ 140.8g(填写“>”、“=”、“<”).
(2)利用装置内空气受热时膨胀,若在插入水中的导管末端观察到气泡冒出,且在停止受热后又出现导管内形成一段水柱的现象,可检测装置的气密性;
(3)反应产生的尾气氮气不能与水反应也不能溶于水,把导管插入水中可以防止空气从导管进入装置而造成氧气与钠发生反应;
(4)为防止钠与空气中氧气等发生反应,制备氮化钠时应先通入氮气排出装置内空气,然后点燃酒精灯加热进行反应;待反应结束后,为防止水倒流,在将导管从试管内水中撤出前应继续通入氮气,撤出导管后再熄灭酒精灯;最后拆除装置,取出产物;
(5)由实验数据表中数据m1、m2与m的差,计算参加反应钠的质量及生成氮化钠的质量,根据反应的化学方程式,由两物质的质量计算氮化钠化学式中x值.
解答:解:(1)反应物是钠和氧气,生成物是氧化钠;根据书写化学方程式的步骤可得;
(2)将活塞k关闭,将末端导管插入试管A的水中,用酒精灯微热硬玻璃管,管内空气受热膨胀,若在导管末端观察到有气泡冒出,且在撤去酒精灯冷却后,装置内气体体积减小,导管内形成一段水柱时,可判断装置气密性良好;
(3)干燥剂可防止水蒸气进入玻璃管与金属钠反应;导管插入水中,可以防止空气从导管进入装置而与钙发生反应,所以,反应过程中末端导管必须插入试管M的水中目的是:液封,防止空气中的氧气通过末端导管进入实验装置;
(4)为防止试管内的水倒流,反应结束后,需要继续通入氮气,将末端导管从试管A中撤出水面,再熄灭酒精灯;
(5)参加反应钠的质量=124g-114.8g=9.2g,反应生成氮化钠的质量=140.8g-114.8g=26g;
2Na+XN2═2NaNX 固体差量
46 46+28x 28x
9.2g 26g 26g-9.2g=16.8g
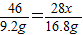
x=3
故答案为:3.
因为钠的总量不变,含有氧化钠的总质量增大,钠与氮(不纯)元素的质量比减小,故通入的N2中混有少量O2测得会小于140.8g
故答案为:
(1)4Na+O2═2Na2O
(2)关闭活塞k,将末端导管插入试管A的水中,用手捂(或酒精灯微热)硬玻璃管,若导管末端有气泡冒出,撤去酒精灯冷却后,在导管内形成一段水柱,则证明装置的气密性良好.
(3)防止水蒸气进入玻璃管与金属钠反应;防止氧气进入玻璃管与金属钠反应
(4)停止加热,继续通氮气至装置冷却
(5)3<
点评:根据实验装置图,分析实验各装置的作用,理解兴趣小组同学制备氮化钠的实验方法,是解答本问题的基础.

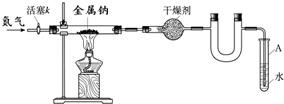
(1)写出钠和氧气反应生成氧化钠的化学方程式
(2)按图连接好实验装置.检查装置气密性的方法是
(3)干燥装置的作用是
(4)制备叠氮钠的操作步骤是:①打开活塞k并通入N2;②点燃酒精灯,进行反应;
③反应结束后,
(5)数据记录如下:
| 空硬玻璃管质量m0/g | 硬玻璃管与钠的质量m1/g | 硬玻璃管与产物的质量m2/g |
| 114.8 | 124 | 140.8 |
②若通入的N2中混有少量O2,如上测得的m2
探究(1):碳酸氢钠(NaHCO3)俗名小苏打,常用于食品和医学工业.某化学兴趣小组的同学对碳酸氢钠进行加热,发现有气泡,同时还剩余白色固体.他们对白色固体进行探究.
【提出问题】这白色固体是什么?
【查阅资料】碳酸氢钠受热易分解生成水、二氧化碳和一种常见的固体.
【提出猜想】
猜想1:白色固体是碳酸钠,
猜想2:白色固体是氢氧化钠
猜想3:白色固体是氢氧化钠和碳酸钠的混合物
【实验探究】
兴趣小组为了确定反应后的固体产物成分,进行了如下实验,请填写下表:
|
实验方案 |
实验现象 |
结论 |
|
步骤一:取少量反应后的固体产物溶于水,加入过量的中性氯化钙溶液,过滤. |
产生白色沉淀 |
猜想1成立 |
|
步骤二:取滤液少许,往滤液中滴入:① |
② |
【实验总结】写出碳酸氢钠受热分解的化学方程式③ .
探究2:某化学兴趣小组把金属钠投到硫酸铜溶液中,实验并非如想象的有红色铜析出,而是生成一种蓝色沉淀.同学们非常好奇并进行实验探究.
【提出问题】金属钠投到硫酸铜溶液中到底发生了怎样的化学反应?
【查阅资料】钠是非常活泼的金属,能与水发生剧烈反应,并放出气体,生成的溶液显碱性
【提出猜想】
猜想1:钠先与水反应生成氢气和某碱溶液,某碱再与硫酸铜反应生成蓝色沉淀;
猜想2:钠先与水反应生成某气体和某碱溶液,某碱再与硫酸铜反应生成蓝色沉淀;
【实验探究】
实验一:同学们把一小块切干净的钠投到装有少量蒸馏水的试管中,点燃生成的气体,听到“噗”的一声后燃烧起来;
实验二:在剩余的溶液中加入硫酸铜溶液,发现有蓝色沉淀.
【实验总结】
①两个猜想中的“某碱”是 ,猜想2中生成的气体是 ;
②水与金属钠反应的化学方程式 .
③请你判断猜想 成立.
金属钠是非常活泼的金属,常温下易与氧气、氮气、水等反应.用钠和氮气制得的叠氮钠用于医药、农药等的有机合成,还可用于防酶,血清防腐,污水含氮量测定等.江海实验学校初三兴趣小组利用如下装置(部分固定装置已略去),制备叠氮钠,并探究其化学式.
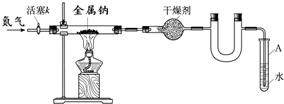
(1)写出钠和氧气反应生成氧化钠的化学方程式______.
(2)按图连接好实验装置.检查装置气密性的方法是______.
(3)干燥装置的作用是______,末端导管必须始终用试管A中的水液封,目的是______.
(4)制备叠氮钠的操作步骤是:①打开活塞k并通入N2;②点燃酒精灯,进行反应;
③反应结束后,______;④拆除装置,取出产物.
(5)数据记录如下:
| 空硬玻璃管质量m0/g | 硬玻璃管与钠的质量m1/g | 硬玻璃管与产物的质量m2/g |
| 114.8 | 124 | 140.8 |
②若通入的N2中混有少量O2,如上测得的m2______ 140.8g(填写“>”、“=”、“<”).