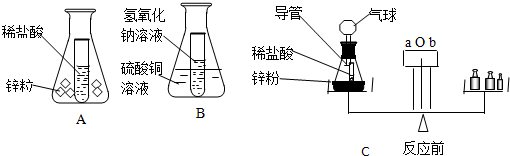
题目内容
16.某水溶液中含有以下离子中的若干种:K+、Cl-、Ca2+、Zn2+、SO42-、CO32-,现取两份100mL溶液进行如下实验(1)第一份加入AgNO3溶液有沉淀产生.
(2)第二份加足量BaCl2溶液后,得沉淀物6.63g,经足量硝酸洗涤、干燥后,沉淀质量为4.66g,在所得滤液中加入AgNO3溶液有沉淀产生.根据上述实验,以下推测不正确的是( )
| A. | Cl-一定存在 | |
| B. | SO42-、和CO32-一定存在,且二者的个数比为1:2 | |
| C. | Ca2+和Zn2+一定存在 | |
| D. | 100ml溶液中K+的质量不小于2.34g |
分析 (1)加入AgNO3溶液有沉淀产生,说明溶液中可能存在Cl-、CO32-、SO42-;
(2)加入足量BaCl2 溶液,得到沉淀6.63g,沉淀经足量盐酸洗涤、干燥后,剩余4.66g,说明生成的沉淀能部分溶于盐酸,所以溶液中含有CO32-、SO42-,而Zn2+、Ca2+和CO32-不共存,所以没有Zn2+、Ca2+;又根据离子守恒,一定有K+,
综上可知溶液中一定有CO32-和SO42-;,可能有Cl-,一定没有Zn2+、Ca2+
解答 解:
(1)加入AgNO3溶液有沉淀产生,说明溶液中可能存在Cl-、CO32-、SO42-;
(2)入足量的BaCl2 溶液,得到沉淀6.63g,沉淀经足量盐酸洗涤、干燥后,剩余4.66g,说明生成的沉淀能部分溶于盐酸,所以溶液中含有CO32-、SO42-,而Zn2+、Ca2+和CO32-不共存,所以没有Zn2+、Ca2,剩余4.66g是BaSO4,n(SO42- )=n(BaSO4)=$\frac{4.66g}{233g/mol}$=0.02mol;BaCO3的质量为m(BaCO3)=6.63g-4.66g=1.97g,n(CO32-)=n(BaCO3)=$\frac{1.97g}{197g/mol}$=0.01mol;
溶液中含有CO32-、SO42,二者的个数比为2:1;又根据离子守恒,一定有K+,再由电荷守恒,可知c(K+)=0.6 mol/L,但是不能确定有没有Cl-,所以c(K+)≥0.6 mol/L,100ml溶液中K+的质量不小于2.34g.
综上可知溶液中一定有K+、CO32-和SO42-,可能有Cl-,一定没有Zn2+、Ca2+
答案:A.
点评 本题考查了常见阴、阳离子的检验,涉及离子共存、离子反应等都是解题需注意的信息,做题时需要细致分析,题目难度适中.

| A. | 黄铜 | B. | 干冰 | C. | 生铁 | D. | 不锈钢 |
| 选项 | 意外事故 | 预防或处理方法 |
| A | 试管中的液体暴沸 | 立即将试管从酒精灯火焰上移开 |
| B | 不慎将燃着的酒精灯碰倒, 洒出的酒精在桌上燃烧 | 应立刻用湿抹布或沙扑盖 |
| C | 浓硫酸不慎溅到皮肤上 | 先用干布拭去,然后用大量水冲洗, 再涂上3%~5%的小苏打溶液 |
| D | 碱液不慎洒在衣服上 | 用水冲洗后,再涂上硫酸溶液 |
| A. | A | B. | B | C. | C | D. | D |
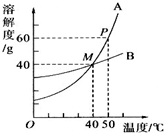
| A. | 40℃时,A、B两物质的溶解度相同 | |
| B. | 50℃时,A物质的饱和溶液溶质质量分数为60% | |
| C. | 降低温度,A、B两物质的溶液均有晶体析出 | |
| D. | B物质中混有少量A物质,可用冷却热饱和溶液的方法提纯 |
| A. | 空气与氧气──带火星的木条 | B. | 硬水与软水──肥皂水 | ||
| C. | 氮气与二氧化碳──燃着的木条 | D. | 铁与铜──观察 |
| A. | 金刚石加工成钻石 | B. | 金刚石切割大理石 | ||
| C. | 白磷燃烧 | D. | 美酒飘香 |