题目内容
【题目】(14分)工业上的常说“三酸两碱”是重要的化工原料。实验室桌面上的五个试剂瓶内(如下图)分别装有属于工业上“三酸两碱”中的“三种浓酸”和“两碱固体”。
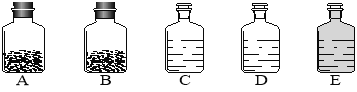
(1)小袁同学没有利用任何试剂就鉴定出了C、D、E三瓶中的三种浓酸。他的做法是:①直接观察试剂瓶颜色,棕色试剂瓶E内的是 (填名称);②分别打开C、D瓶的瓶塞,观察到 ,说明C瓶内的是浓盐酸,D瓶内的是浓硫酸。
(2)小白同学在查阅A、B瓶内的“两碱”的制备方法时,根据收集的信息,绘制了如下一个框图。
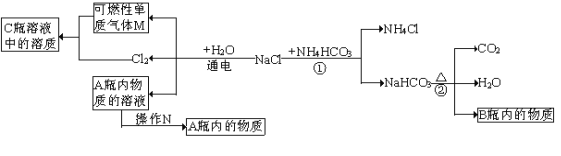
注:整个框图中每个化学反应涉及的物质已全部给出。
根据框图,依据化学反应前后元素种类守恒的相关知识,回答下列问题。
Ⅰ.写出B瓶内物质的化学式 ,并写出②反应的化学方程式 。
Ⅱ.框图中的①反应所属的反应类型是 ,操作N的名称是 。
Ⅲ.请选用一种物理方法鉴别A、B瓶内的物质: ,
在实验室中能否通过滴加酚酞试液来区别A、B的溶液? (填“能”或“否”),为什么? 。
(3)在实际工业生产中得到的B物质中往往会含有少量的NaCl,现在一烧杯中盛有20.4gB物质和NaCl 组成的固体混合物。向其中逐渐滴加溶质质分数为10%的稀盐酸。放出气体的总质量与所滴入稀盐酸的质量关系曲线如下图所示,请根据题意回答问题:
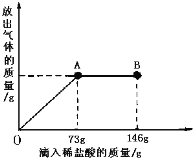
①当滴加稀盐酸至图中B点时,烧杯中溶液的pH 7(填>、=、<)。
②当滴加稀盐酸至图中A点时,烧杯中为不饱和溶液(常温),通过计算求出其中溶质的质量分数。(计算结果保留一位小数)(4分)
【答案】(1)浓硝酸 C瓶口有白雾 D瓶口无白雾
(2)Ⅰ.Na2CO3 2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
Ⅱ.复分解反应 蒸发结晶
Ⅲ.取少量A、B瓶中的物质溶于水中,温度升高明显的是氢氧化钠
否 碳酸钠溶液也为碱性
(3)①﹤ ②24.2%(4分)(要求:计算和推理过程合理、正确。)
【解析】
试题分析:(1)①根据酸的性质可知,浓硝酸见光易分解,②浓盐酸具有挥发性,浓硫酸不具有挥发性,则C瓶口有白雾出现;(2)Ⅰ根据图可知,B物质为碳酸钠,化学方程式为:2NaHCO3![]() Na2CO3+H2O+CO2↑;Ⅱ.根据反应物和生成物的种类可知反应类型为:复分解反应 ;根据氯化钠和水的通电反应可知A为氢氧化钠溶液,则操作N为蒸发结晶,得到氢氧化钠固体;Ⅲ.取少量A、B瓶中的物质溶于水中,温度升高明显的是氢氧化钠 ;否氢氧化钠和 碳酸钠溶液都为碱性,都能使酚酞试液变为红色;(3)①当滴加稀盐酸至图中B点时,加入盐酸过量,所以溶液呈酸性;②根据稀盐酸中溶质质量计算出生成二氧化碳质量和氯化钠质量,然后利用混合物中氯化钠质量与生成氯化钠质量计算出反应后溶液中溶质质量,最后除以溶液质量即可。具体步骤如下;
Na2CO3+H2O+CO2↑;Ⅱ.根据反应物和生成物的种类可知反应类型为:复分解反应 ;根据氯化钠和水的通电反应可知A为氢氧化钠溶液,则操作N为蒸发结晶,得到氢氧化钠固体;Ⅲ.取少量A、B瓶中的物质溶于水中,温度升高明显的是氢氧化钠 ;否氢氧化钠和 碳酸钠溶液都为碱性,都能使酚酞试液变为红色;(3)①当滴加稀盐酸至图中B点时,加入盐酸过量,所以溶液呈酸性;②根据稀盐酸中溶质质量计算出生成二氧化碳质量和氯化钠质量,然后利用混合物中氯化钠质量与生成氯化钠质量计算出反应后溶液中溶质质量,最后除以溶液质量即可。具体步骤如下;
解:设生成二氧化碳质量为X,生成氯化钠质量为Y ,原混合物中碳酸钠质量为M
根据题意知,消耗氯化氢的质量=73克*10%=7.3克
Na2CO3+2HCl==2NaCl+H2O+CO2↑
106 73 117 44
M 7.3克 Y X
106/73=M/7.3克 M=10.6克
73/117=7.3克/Y Y=11.7克
44/73=X/7.3克 X=4.4克
则反应后溶质质量=20.4克-10.6克 +11.7克=21.5克
反应后溶液质量=20.4克 +73克-4.4克=89克
所以所得氯化钠溶液质量分数=21.5克/89克 *100%=24.2%
答:略

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案