题目内容
【题目】根据如图回答问题. 
(1)仪器a的名称是 .
(2)实验室制取氧气时.选用的收集装置是(填字母序号.下同).如图E所示,铁丝与氧气反应的化学方程式为
(3)实验室用大理石和稀盐酸制取二氧化碳的化学方程式为 , 如图F所示,将二氧化碳倒入烧杯中,观察到燃烧的蜡烛是(填“上层”或“下层”)先熄灭.
【答案】
(1)酒精灯
(2)C;3Fe+2O2 ![]() ?Fe3O4
?Fe3O4
(3)CaCO3+2HCl=CaCl2+H2O+CO2↑;下层
【解析】解:(1)仪器a是酒精灯;故填:酒精灯.(2)氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集;铁丝与氧气在点燃的条件下生成四氧化三铁,配平即可;所以答案是:C;3Fe+2O2 ![]() Fe3O4;(3)实验室制取CO2 , 是在常温下,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热;将二氧化碳倒入烧杯中,观察到燃烧的蜡烛自下而上依次熄灭,因为二氧化碳具有的性质是:二氧化碳的密度比空气的密度大,二氧化碳不可燃且不助燃. 故填:CaCO3+2HCl=CaCl2+H2O+CO2↑;下层.
Fe3O4;(3)实验室制取CO2 , 是在常温下,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热;将二氧化碳倒入烧杯中,观察到燃烧的蜡烛自下而上依次熄灭,因为二氧化碳具有的性质是:二氧化碳的密度比空气的密度大,二氧化碳不可燃且不助燃. 故填:CaCO3+2HCl=CaCl2+H2O+CO2↑;下层.
【考点精析】解答此题的关键在于理解氧气的化学性质的相关知识,掌握氧气的化学性质:特有的性质:支持燃烧,供给呼吸,以及对氧气的制取装置的理解,了解发生装置:固固加热型、固液不加热型.

【题目】下表是KNO3在不同温度时的溶解度,请回答下列问题.
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
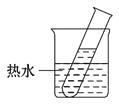
(1)分析表中数据,归纳出KNO3的溶解度随温度变化的规律.
(2)20 ℃时,在装有5 g KNO3晶体的试管中,加入10 g水并充分振荡,此时所得溶液为(选填“饱和”或“不饱和”)溶液.再将该试管放入盛有热水的烧杯中,使试管内溶液温度升至60 ℃,此时试管内的溶液中溶质与溶剂的质量比为.