题目内容
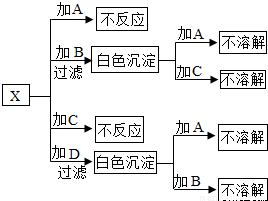 A、B、C、D分别是氯化钠、硝酸钡、氢氧化钠和盐酸四种无色溶液中的一种,现用一种无色溶液X把A、B、C、D一一鉴别了出来,已知X是含有镁元素的化合物.鉴别方法见下图所示.(所加溶液均过量,使反应完全)
A、B、C、D分别是氯化钠、硝酸钡、氢氧化钠和盐酸四种无色溶液中的一种,现用一种无色溶液X把A、B、C、D一一鉴别了出来,已知X是含有镁元素的化合物.鉴别方法见下图所示.(所加溶液均过量,使反应完全)完成下列问题:
(1)确定A、B、C、D、X各代表什么物质(用化学式表示):
A______,B______,C______,D______,X______.
(2)写出下列有关反应的化学方程式:
X和B:______.
X和D:______.
【答案】分析:镁离子能与氢氧根离子形成白色沉淀,因此能确定氢氧化钠.
钡离子能与碳酸根离子和硫酸根离子形成白色沉淀;碳酸镁和碳酸钡能溶于盐酸,硫酸钡不能溶于盐酸.因此可以排除X中含有碳酸根离子,X中含有的阴离子只能是硫酸根离子.
解答:解:(1)由于X含Mg2+,能将Mg2+沉淀的是OH-,说明B、D中的一种物质是氢氧化钠.
由于X能与四种物质产生两种沉淀,因此X含有的阴离子必然能将Ba2+沉淀,说明B、D中的另一种物质是硝酸钡,同时说明A、C分别是氯化钠和盐酸中的一种,还能说明X中的阴离子可能为CO32-、SO42-.
由于A、C与X不反应,MgCO3易溶于酸,因此X不能是MgCO3,只能是MgSO4.
由于X与B产生的沉淀不溶于A、C,说明产生的沉淀为BaSO4,B为Ba(NO3)2;
由于X与D产生的沉淀溶于A,说明产生的沉淀是Mg(OH)2,A为盐酸,化学式为HCl,C为NaCl,D为NaOH.
(2)硫酸镁与硝酸钡反应生成硝酸镁和硫酸钡沉淀.
该反应的化学方程式为:MgSO4+Ba(NO3)2═Mg(NO3)2+BaSO4↓.
硫酸镁与氢氧化钠反应生成硫酸钠和氢氧化镁沉淀.
该反应的化学方程式为:MgSO4+2NaOH═Na2SO4+Mg(OH)2↓.
故答案为:
(1)HCl;Ba(NO3)2;NaCl;NaOH;MgSO4.
(2)MgSO4+Ba(NO3)2═Mg(NO3)2+BaSO4↓;MgSO4+2NaOH═Na2SO4+Mg(OH)2↓.
点评:本题主要考查离子的鉴定、物质的推断和化学方程式的书写,难度较大.
钡离子能与碳酸根离子和硫酸根离子形成白色沉淀;碳酸镁和碳酸钡能溶于盐酸,硫酸钡不能溶于盐酸.因此可以排除X中含有碳酸根离子,X中含有的阴离子只能是硫酸根离子.
解答:解:(1)由于X含Mg2+,能将Mg2+沉淀的是OH-,说明B、D中的一种物质是氢氧化钠.
由于X能与四种物质产生两种沉淀,因此X含有的阴离子必然能将Ba2+沉淀,说明B、D中的另一种物质是硝酸钡,同时说明A、C分别是氯化钠和盐酸中的一种,还能说明X中的阴离子可能为CO32-、SO42-.
由于A、C与X不反应,MgCO3易溶于酸,因此X不能是MgCO3,只能是MgSO4.
由于X与B产生的沉淀不溶于A、C,说明产生的沉淀为BaSO4,B为Ba(NO3)2;
由于X与D产生的沉淀溶于A,说明产生的沉淀是Mg(OH)2,A为盐酸,化学式为HCl,C为NaCl,D为NaOH.
(2)硫酸镁与硝酸钡反应生成硝酸镁和硫酸钡沉淀.
该反应的化学方程式为:MgSO4+Ba(NO3)2═Mg(NO3)2+BaSO4↓.
硫酸镁与氢氧化钠反应生成硫酸钠和氢氧化镁沉淀.
该反应的化学方程式为:MgSO4+2NaOH═Na2SO4+Mg(OH)2↓.
故答案为:
(1)HCl;Ba(NO3)2;NaCl;NaOH;MgSO4.
(2)MgSO4+Ba(NO3)2═Mg(NO3)2+BaSO4↓;MgSO4+2NaOH═Na2SO4+Mg(OH)2↓.
点评:本题主要考查离子的鉴定、物质的推断和化学方程式的书写,难度较大.

练习册系列答案
 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案
相关题目
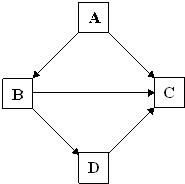 物质之间的相互转化是化学中的重要知识.某同学在复习物质性质时,绘制了框图.框图中“→”表示物质之间可以向箭头所指方向一步转化.根据框图,回答下列问题.
物质之间的相互转化是化学中的重要知识.某同学在复习物质性质时,绘制了框图.框图中“→”表示物质之间可以向箭头所指方向一步转化.根据框图,回答下列问题.
 A、B、C、D分别是NaNO3、NaOH、HNO3和Ba(NO3)2四种溶液中的一种,现用MgSO4 溶液按右图所示的操作,可将它们
A、B、C、D分别是NaNO3、NaOH、HNO3和Ba(NO3)2四种溶液中的一种,现用MgSO4 溶液按右图所示的操作,可将它们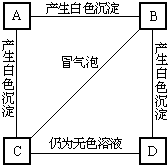 (1)A、B、C、D分别是Ba(NO3)2、Na2CO3、MgCl2和H2SO4中的各一种溶液.从表标明了它们之间两两相混的现象:根据实验事实可知:
(1)A、B、C、D分别是Ba(NO3)2、Na2CO3、MgCl2和H2SO4中的各一种溶液.从表标明了它们之间两两相混的现象:根据实验事实可知: