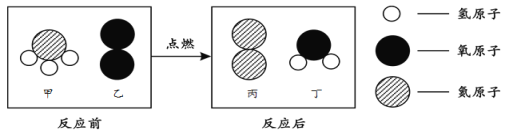
题目内容
【题目】炼铁产生的废渣中含有大量CuS及少量铁和铁的化合物,工业上以该废渣为原料生产CuCl 2的流程图如图:
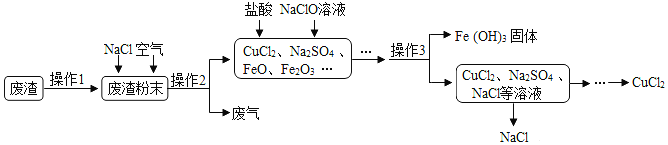
(1)操作1:粉碎。粉碎的目的是______;
(2)操作2:焙烧。高温条件下,通入空气,CuS和NaCl反应生成了CuCl2和Na2SO4,化学方程式为______;
(3)操作3:______(填操作名称)该操作用到的玻璃容器为______;
(4)流程图中能循环利用的物质是______。
【答案】增大接触面积,加快反应的进行 CuS+2NaCl+2O2 ![]() CuCl2+Na2SO4 过滤 烧杯 氯化钠
CuCl2+Na2SO4 过滤 烧杯 氯化钠
【解析】
(1)粉碎的目的是增大反应物的接触面积,加快反应的速率,故填增大接触面积,加快反应的进行。
(2)高温条件下,CuS、O2和NaCl反应生成了CuCl2和Na2SO4,故反应的化学方程式写为:CuS+2NaCl+2O2![]() CuCl2+Na2SO4。
CuCl2+Na2SO4。
(3)操作3是将难溶性固体与溶液分离,是过滤操作,故填过滤;
过滤时用到的玻璃容器为烧杯,故填烧杯。
(4)由流程可知,反应过程中氯化钠是反应物,最后又生成了氯化钠,所以循环利用的物质是氯化钠,故填氯化钠。

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目