题目内容
【题目】下图中A、B、C、D是四种粒子的结构示意图。请回答下列问题:
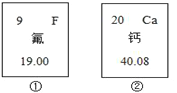
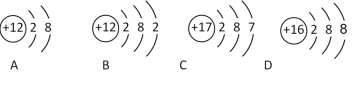
(1)氟元素的相对原子质最为_______,钙元素的原子序数为_______;
(2)图中A、B、C、D属于_______种元素的粒子;
(3)C粒子的元素位于第_______周期 。
(4)化学性质相似的是________ (填序号,下同);
(5)A、B、C、D四种粒子中,不具备稳定结构的是_________;
(6)在化学反应中容易失电子的是________;
(7)其中属于阴离子的是_________,其离子符号是_______。
【答案】19.00,20;三三①和C或 ②和BBCBDS2-
【解析】
(1)在元素周期表中,元素名称左上角的数字为原子的序数,右上角是该元素的符号。名称下边的数值是原子的相对原子质量。氟元素的相对原子质最为19.00,钙元素的原子序数为20;
(2)元素是有相同质子数即核电荷数的同一类原子的总称,质子数决定原子的类别,图中A、B、C、D属于3种元素的粒子;
(3)在元素周期表中,元素的周期数等于原子的电子层数,C粒子的元素位于第三周期 ;(4)原子的化学性质主要由最外层电子数决定,当最外层电子数小于4时,反应中易失去电子成为阳离子;当最外层电子数大于4时,反应中易得到电子成为阴离子;原子核外只有一个电子层且电子数为2,或者最外层电子数为8的结构为稳定结构,不易得失电子。具有稳定结构的原子的化学性质相似,非稳定结构的原子,最外层电子数相同的原子化学性质相似,化学性质相似的是①和C或 ②和B;
(5)A、B、C、D四种粒子中,B、C的电子层数多于一层,最外层电子数不是8,不具备稳定结构;
(6)B原子的最外层电子数为2,小于4,在化学反应中容易失电子形成阳离子;
(7)同一原子中,质子数=核外电子数=核电荷数=原子序数;在阳离子中:质子数>核外电子;在阴离子中:质子数<核外电子;其中属于阴离子的是D,其离子符号是S2-。

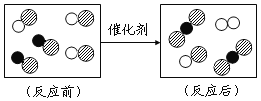
【题目】今天又是化学实验室开放日,老师拿出两瓶无标签的试剂,分别是固体和液体,他取少量试剂在试管中混合,立即产生一种无色气体。我们对此气体展开了一系列探究:
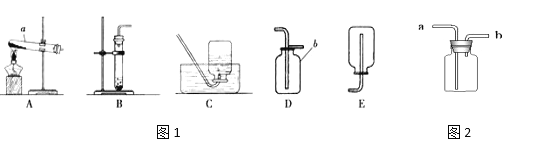
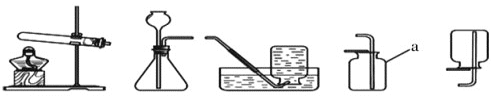
(1)写出图3中标有序号的仪器名称a_______
(2)①此气体是什么物质?验证它的实验方案如下:
猜想 | 实验步骤 | 现象及结论 |
此气体可能是:_____ | ______________ | ______________ |
②产生此气体的化学方程式可能是_________;
③我想制取该气体,可以分别选取图1中的______作发生装置和________作收集装置(填序号);
④如用图2装置收集该气体,气体由 ________端导入;
⑤若用加热高锰酸钾来制取氧气,所选用的发生装置是________(在图1中选择),产生氧气的化学方程式是:_____________。