题目内容
【题目】将等质量的铝粉和铁粉,分别放入质量相等、溶质质量分数相同的稀硫酸中,生成氢气质量(m)随反应时间(t)的变化曲线如图所示.写出A与硫酸反应的化学方程式 .对于该图象的理解,下列说法正确的是 (填序号).
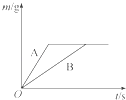
①反应结束后两种金属一定都有剩余
②铝一定有剩余
③铁一定有剩余,铝反应完
④反应结束后消耗两种金属的质量相等
⑤反应结束后稀硫酸都没有剩余
⑥反应结束后所得溶液质量相等.
【答案】2Al+3H2SO4=Al2(SO4)3+3H2↑; ③⑤.
【解析】
(1)铝与硫酸反应生成硫酸铝和氢气,故其化学方程式是:2Al+3H2SO4=Al2(SO4)3+3H2↑.
(2)由已知:“等质量的铝粉和铁粉,分别放入质量相等、溶质质量分数相同的稀硫酸”反应,进行分析:
①由图示可知:生成的氢气的质量相等,所以硫酸均反应完;由方程式分析:2Al+3H2SO4=Al2(SO4)3+3H2↑,Fe+H2SO4═FeSO4+H2↑,二者反应结束后,可能金属都有剩余,也可能铁恰好反应完,铝有剩余;故“反应结束后两种金属一定都有剩余”的说法错误;
②铝可能有剩余,故错误;
③铁一定有剩余,铝反应完,故说法正确;
④根据化学方程式2Al+3H2SO4=Al2(SO4)3+3H2↑,可知每54g铝生成6g氢气,根据化学方程式Fe+H2SO4═FeSO4+H2↑,可知每56g锌反应生成2g氢气;所以若是相等质量的铝粉和铁与硫酸反应,铝生成氢气多,而不会相等,故错误;
⑤由图示可知:生成的氢气的质量相等,所以硫酸均反应完,故说法正确;
⑥因为“等质量的铝粉和铁粉,分别放入质量相等、溶质质量分数相同的稀硫酸”反应,所以反应物的总质量相等;依据质量守恒定律,反应后溶液的质量=反应前的总质量﹣气体的质量﹣不溶物的质量,图示中生成氢气的质量相等,但剩余的不溶物的质量不同,所以反应结束后所得溶液质量不相等,故错误.

