题目内容
石灰石是用于生产水泥的原材料,为探究石灰石样品中含碳酸钙的质量分数,某水泥厂的技术人员取回了若干块矿石样品,并对样品进行分析探究,采用的方法是:取用8g石灰石样品,把40g稀盐酸分四次加入,探究过程所得数据见下表:(已知石灰石样品中含有的杂质不溶于水,不与盐酸反应)
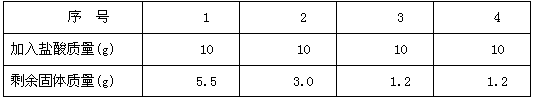
计算:
(1)样品中碳酸钙的质量分数是多少?
(2) 要得到112kg的CaO,需要质量分数为80%的石灰石多少千克?
(化学方程式为:CaCO3 CaO+CO2↑)
CaO+CO2↑)
(1)样品中碳酸钙的质量分数是多少?
(2) 要得到112kg的CaO,需要质量分数为80%的石灰石多少千克?
(化学方程式为:CaCO3
 CaO+CO2↑)
CaO+CO2↑) (1)样品中含CaCO3的质量分数为:85%
(2)设:需要质量分数为80%的石灰石X。
CaCO3 CaO + CO2↑
CaO + CO2↑
100 56
X×80% 112
100∶56 = X×80%∶112 ,X=250Kg
答:需要质量分数为80%的石灰石250Kg。
(2)设:需要质量分数为80%的石灰石X。
CaCO3
 CaO + CO2↑
CaO + CO2↑100 56
X×80% 112
100∶56 = X×80%∶112 ,X=250Kg
答:需要质量分数为80%的石灰石250Kg。

练习册系列答案
相关题目