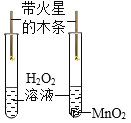
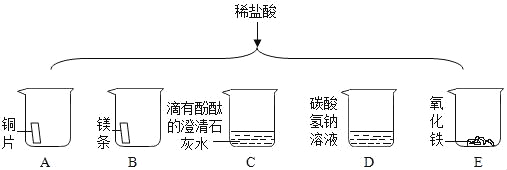
题目内容
【题目】在做完“用稀盐酸和石灰石反应制取二氧化碳”的实验后,小明突然想到:是否可以测得实验所用的石灰石中碳酸钙的含量呢?小明又进行了如下实验:①将试管中反应的剩余物过滤并多次用蒸馏水洗涤,得到滤液和滤渣.②向滤渣中滴加稀盐酸,无明显的现象.③将滤渣干燥后称量,质量为0.5g④向滤液中加入![]() 的
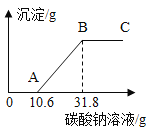
的![]() 溶液,获得了相关的数据,并绘制成如图所示的图象.根据小明的实验过程回答下列问题.(假设石灰石中的其余杂质不与稀盐酸反应)
溶液,获得了相关的数据,并绘制成如图所示的图象.根据小明的实验过程回答下列问题.(假设石灰石中的其余杂质不与稀盐酸反应)
(1)第②步中小明向滤渣中加入稀盐酸的目的是为了 ______ .
(2)在![]() 溶液加到图象中显示的C点时,溶液中所含的溶质 ______ .
溶液加到图象中显示的C点时,溶液中所含的溶质 ______ .
(3)第①步中如果在过滤时没有用蒸馏水多次洗涤,则测得碳酸钙的含量将 ______(选填“偏大”、“不变”或“偏小”)
(4)根据图象及相关的数据可求得石灰石中碳酸钙的含量为多少______?(![]() :12,Ca:40,Na:23,O:16,Cl;
:12,Ca:40,Na:23,O:16,Cl;![]() )
)
【答案】检验滤渣中是否还有剩余的CaCO3 NaCl和Na2CO3 偏小 80%
【解析】
(1)由于碳酸钙难溶于水,而盐酸和碳酸钙反应生成二氧化碳气体,所以第②步中小明向滤渣中加入稀盐酸的目的是为了检验滤渣中是否还有剩余的CaCO3;
(2)盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,而图象中显示的C点时,说明加入的碳酸钠溶液过量,所以Na2CO3溶液加到图象中显示的C点时,溶液中所含的溶质为氯化钠和碳酸钠;
(3)第①步中如果在过滤时没有用蒸馏水多次洗涤,则会造成碳酸钙的质量减小,所以测得碳酸钙的质量分数偏小;
(4)Na2CO3+CaCl2=CaCO3↓+2NaCl ![]() 石灰石中碳酸钙质量等于氯化钙和碳酸钠反应生成碳酸钙质量。
石灰石中碳酸钙质量等于氯化钙和碳酸钠反应生成碳酸钙质量。
设石灰石中碳酸钙的质量为x,
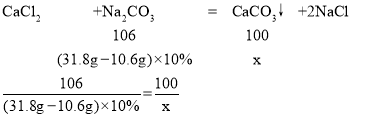
解得:x=2g
石灰石中碳酸钙的含量为:![]() ×100%%=80%
×100%%=80%
答:石灰石中碳酸钙的含量为80%。
故答案为:(1)检验滤渣中是否还有剩余的CaCO3;
(2)NaCl和Na2CO3;
(3)偏小;
(4)80%。

 阅读快车系列答案
阅读快车系列答案【题目】如下图所示,锥形瓶中盛有气体Ⅹ,胶头滴管中盛有液体Y。若挤压胶头滴管使液体滴入锥形瓶中,振荡一段时间后可见小气球a鼓起。下列各组中,不会出现上述现象的是( )
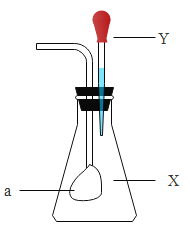
X | Y | |
A | CO2 | Ca(OH)2 |
B | CO2 | NaOH |
C | CO | Ba(OH)2 |
D | SO2 | NaOH |
A.AB.BC.CD.D
【题目】下列实验方案设计不能达到对应实验目的的是( )
实验目的 | A检查装置的气密性 | B比较空气与人体呼出的气体中CO2含量 | C测定空气中氧气的含量 | D探究MnO2能否加快H2O2分解 |
实验方案 |
|
|
|
|
A. AB. BC. CD. D
【题目】某兴趣小组对氯酸钾分解反应的催化剂进行研究,在相同的加热条件下,用下图装置完成表中实验:
编号 | 氯酸钾质量/g | 催化剂 | 催化剂质量/g | 收集50mL氧气所需时间/s |
实验一 | 5 | - | - | 171 |
实验二 | 5 | 二氧化锰 | 0.5 | 49 |
实验三 | 5 | 三氧化二铁 | 0.5 | 58 |
实验四 | 5 | 氯化钾 | 0.5 | 154 |
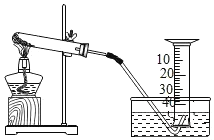
(1)设置实验一的目的是______。
(2)表中所列三种催化剂的催化效果最好的是_______。
(3)写出氯酸钾分解的文字表达式:_______。
(4)由实验一和实验四可知,氯化钾______(填“有”或“无”)催化作用。维持加热条件不变,用实验一再继续收集收集50mL氧气,所需时间明显少于171s,解释原因:_______。
(5)同种催化剂,催化剂的质量多少可能影响催化效果,请设计实验方案进行验证______。
(6)同种催化剂,还有哪些因素可能影响催化效果,请你再探究(探究一种因素即可)。影响因素:______;实验方案:______。