题目内容
【题目】如图是甲、乙、丙三种常见固体物质的溶解度曲线,下列说法正确的是

A. t2℃时,物质甲的饱和溶液的溶质质量分数为50%
B. t1℃时,甲、丙的饱和溶液中溶质与溶液的质量比均为1∶5
C. 除去乙物质中少量甲物质可采取降温结晶的方法
D. 将甲、乙的饱和溶液分别从t1℃升温到t2℃,溶质质量分数都不变
【答案】D
【解析】A、由溶解度曲线可知,t2℃时甲的溶解度为50g,故该温度时甲的饱和溶液的溶质质量分数=![]() =33.3%,错误;B、t1℃时,甲、丙的溶解度相等均是20g,那么饱和溶液中溶质与溶液的质量比=20g:120g=1∶6,错误;C、乙的溶解度随温度的变化变化不大,故要除去甲得到纯净的乙可采用蒸发结晶的方法,错误;D、由溶解度曲线可知,甲和乙的溶解度均随温度的升高而增大,故将甲、乙的饱和溶液分别从t1℃升温到t2℃,甲和乙均变成不饱和溶液,由于溶质和溶剂的质量不变,故溶质质量分数不变,正确。故选D。
=33.3%,错误;B、t1℃时,甲、丙的溶解度相等均是20g,那么饱和溶液中溶质与溶液的质量比=20g:120g=1∶6,错误;C、乙的溶解度随温度的变化变化不大,故要除去甲得到纯净的乙可采用蒸发结晶的方法,错误;D、由溶解度曲线可知,甲和乙的溶解度均随温度的升高而增大,故将甲、乙的饱和溶液分别从t1℃升温到t2℃,甲和乙均变成不饱和溶液,由于溶质和溶剂的质量不变,故溶质质量分数不变,正确。故选D。

 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案【题目】碲(Te)被誉为“现代工业、国防与尖端技术的维生素,创造人间奇迹的桥梁”。实验室模拟提取碲的一个实验是:取某含碲溶液于烧瓶中,加入适量的NaCl,加热到一定温度,持续通入SO2,待反应一段时间,过滤得到粗碲。
(1)反应的总反应方程式为TeOSO4 + 2SO2 + 3__X__ ![]() Te↓+ 3H2SO4,则X为_________(填化学式)
Te↓+ 3H2SO4,则X为_________(填化学式)
(2)为探究获得较高粗碲沉淀率的反应条件,某研究小组在控制NaCl浓度和SO2流量不变的条件下,进行下述对比试验,数据如下:
实验 | 温度/℃ | 反应时间/h | 粗碲沉淀率/% |
a | 65 | 3.0 | 65.0 |
b | 80 | 3.0 | 98.9 |
c | 80 | 2.0 | 98.9 |
d | 90 | 2.0 | 97.0 |
①该小组研究的反应条件是_________________和_____________。
②实验a和b的目的是______________________________。
③在上述四组实验中,最佳的反应条件是_______℃和_______h。
④为了提升设备利用效率和节约能源,可进一步优化反应条件测定粗碲沉淀率。若再设计对比实验,选择的反应条件还可以是__________(填选项)。
A.80℃,1.5h B.80℃,2.5h C.70℃,2.0h D.95℃,2.0h
【题目】某实验小组的同学用氢氧化钠溶液和稀硫酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液滴加稀硫酸一会儿后,发现忘记了滴加指示剂。此时,他们停止滴加稀硫酸,并对烧杯内溶液中溶质的成分进行探究。Ⅰ.写出该中和反应的化学方程式_________。
Ⅱ.探究烧杯内溶液中溶质的成分:
【提出问题】该烧杯内溶液中溶质是什么?
【进行猜想】
猜想一:可能是Na2SO4与NaOH;猜想二:可能只是Na2SO4;猜想三:可能是_________。
【查阅资料】Na2SO4溶液呈中性。
【实验探究】
实验步骤 | 实验现象 | 实验结论 |
(1)取少量烧杯内溶液于试管中,滴入几滴酚酞溶液,振荡 | _________ | 猜想一不正确 |
(2)取少量烧杯内溶液于另一支试管中,滴加碳酸钠溶液 | _________ | 猜想二不正确,猜想三正确 |
【反思与拓展】
(1)探究猜想三成立,除以上方案外,下列哪些物质也能完成该实验?_________(填序号)
A.pH试纸 B.铜 C.氧化铜 D.氢氧化铜
(2)甲、乙两位同学准备测定反应后溶液中H2SO4的质量分数。
①甲同学取50g该溶液于烧杯中,逐滴滴入溶质质量分数为10%的NaOH溶液,反应过程中溶液的pH变化如右图所示,求溶液中H2SO4的质量分数_________。(写出计算过程)
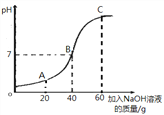
②试写出A点溶液中的溶质_________。
③乙同学改用BaCl2溶液代替NaOH溶液,根据生成沉淀的质量来确定溶液中H2SO4的质量分数,你认为结果将_______(填“偏大”“偏小”或“无影响”)。