题目内容
电子数相同,质子数不同的两种粒子,它们可能是( )A.两种不同元素的原子
B.两种不同元素的离子
C.两种不同的分子
D.同种元素的原子和离子
【答案】分析:采用逐一验证法:
A、原子是电中性的,结合元素的概念分析.
B、结合元素的概念和离子的特点进行分析.
C、根据分子是电中性的进行分析.
D、根据元素的概念及原子和离子的关系进行分析.
解答:解:A、同种元素的原子质子数肯定是相等的,不合题意.
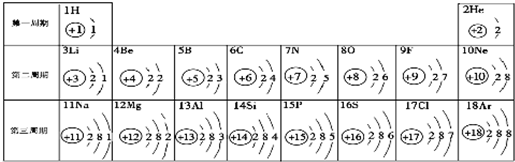
B、不同的元素,质子数肯定不相等,又是离子,电子数可以不相等,如8电子结构的离子O2-、F-、Na+、Mg2+、Al3+,当然还有18电子的离子组.符合题意.
C、因为分子是呈电中性的,不可能出现电子数和质子数不相等,所以不合题意.
D、同种元素的原子和离子的质子数是相等的,不符合题意.
故选B
点评:方法二:正向分析法:根据分子和原子都是呈电中性的理论,题意要求质子数不同、电子数相等,那么这两种粒子必须是离子状态.分析选项可以发现只有B选项是离子,故选B.
A、原子是电中性的,结合元素的概念分析.
B、结合元素的概念和离子的特点进行分析.
C、根据分子是电中性的进行分析.
D、根据元素的概念及原子和离子的关系进行分析.
解答:解:A、同种元素的原子质子数肯定是相等的,不合题意.
B、不同的元素,质子数肯定不相等,又是离子,电子数可以不相等,如8电子结构的离子O2-、F-、Na+、Mg2+、Al3+,当然还有18电子的离子组.符合题意.
C、因为分子是呈电中性的,不可能出现电子数和质子数不相等,所以不合题意.
D、同种元素的原子和离子的质子数是相等的,不符合题意.
故选B
点评:方法二:正向分析法:根据分子和原子都是呈电中性的理论,题意要求质子数不同、电子数相等,那么这两种粒子必须是离子状态.分析选项可以发现只有B选项是离子,故选B.

练习册系列答案
相关题目
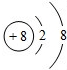
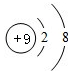

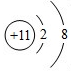
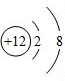
 ,其中X值为
,其中X值为