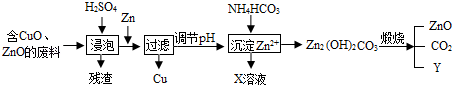
题目内容
.如右图所示装置进行实验(图中铁架台等仪器均已略去)。在I中加入一定量固体和过量液体试剂后,塞紧橡皮塞,立即打开止水夹,Ⅱ中有气泡冒出且溶液变浑浊,一段时间后关闭止水夹,Ⅰ中液体流入Ⅱ中,Ⅱ中溶液由浑浊变澄清。符合以上实验现象的Ⅰ和Ⅱ中应加入的试剂是
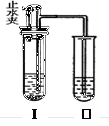
| | A | B | C | D |
| I | 石灰石、 稀盐酸 | 纯碱、 稀盐酸 | 锌片、 稀盐酸 | 二氧化锰、 H2O2溶液 |
| Ⅱ | NaOH | Ca(OH)2 | Ca(OH)2 | NaOH |

B
A、打开止水夹时,I中碳酸钙和盐酸反应会生成气体二氧化碳,Ⅱ中会看到气泡,但是二氧化碳和氢氧化钠反应不会出现沉淀,被压入的稀盐酸和碳酸钠溶液反应,看不到溶液由浑浊变澄清,不符合实验现象,故A错误;
B、打开止水夹时,I中碳酸钠和稀盐酸反应会生成气体二氧化碳,Ⅱ中会看到气泡,关闭止水夹后,被压入的稀盐酸和碳酸钙反应,看到溶液由浑浊变澄清,符合实验现象,故B正确;
C、打开止水夹时,I中锌粒和稀盐酸反应会生成氢气,Ⅱ中会看到气泡,关闭止水夹后,被压入的稀盐酸和氢氧化钙溶液会反应,但看不到溶液由浑浊变为澄清,不符合实验现象,故C错误;
D、打开止水夹时,I中二氧化锰和双氧水反应生成氧气,Ⅱ中会看到气泡,但是关闭止水夹后被压入的双氧水不会和氢氧化钠溶液会反应,看不到溶液由浑浊变为澄清,不符合实验现象,故D错误.
故选B
B、打开止水夹时,I中碳酸钠和稀盐酸反应会生成气体二氧化碳,Ⅱ中会看到气泡,关闭止水夹后,被压入的稀盐酸和碳酸钙反应,看到溶液由浑浊变澄清,符合实验现象,故B正确;
C、打开止水夹时,I中锌粒和稀盐酸反应会生成氢气,Ⅱ中会看到气泡,关闭止水夹后,被压入的稀盐酸和氢氧化钙溶液会反应,但看不到溶液由浑浊变为澄清,不符合实验现象,故C错误;
D、打开止水夹时,I中二氧化锰和双氧水反应生成氧气,Ⅱ中会看到气泡,但是关闭止水夹后被压入的双氧水不会和氢氧化钠溶液会反应,看不到溶液由浑浊变为澄清,不符合实验现象,故D错误.
故选B

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目