题目内容
(2012?朝阳)如表是探究小组的同学们对Mn、Al、Cu三种金属活动性顺序进行了探究的过程.
【作出猜想】1Mn的金属活动性比Al强.2Mn的金属活动性比Cu强.
【实验过程】
【实验结论】三种金属的活动性由强及弱的顺序是
【结论应用】能否用铝制容器盛装波尔多液(含硫酸铜 )
【作出猜想】1Mn的金属活动性比Al强.2Mn的金属活动性比Cu强.
【实验过程】
| 步骤 | 现象 | 过程 |
| 1.取Mn片,插入盛有硫酸铝溶液的试管中. | 没有明显现象 | Mn的金属活动性比Al弱 Mn的金属活动性比Al弱 |
| 2. 取Mn片,插入盛有硫酸铜溶液的试管中 取Mn片,插入盛有硫酸铜溶液的试管中 |
Mn片上由红色物质生成 Mn片上由红色物质生成 |
Mn的金属活动性比Cu强 |
Al、Mn、Cu
Al、Mn、Cu
【结论应用】能否用铝制容器盛装波尔多液(含硫酸铜 )
不能
不能
理由是铝的金属活动性大于铜,铝与硫酸铜反应
铝的金属活动性大于铜,铝与硫酸铜反应
.分析:根据在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置越靠前,反应的速度越快,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.据此分析回答有关的问题.
解答:解:【实验过程】
1、由金属活动顺序表的应用可知,取Mn片,插入盛有硫酸铝溶液的试管中.没有明显现象.说明了Mn的金属活动性比Al弱;
2、为了比较Mn与Cu的活动性大小,可取Mn片,插入盛有硫酸铜溶液的试管中,现象是Mn片上由红色物质生成.说明了Mn的金属活动性比Cu强.
【实验结论】由上述实验可知,三种金属的活动性由强及弱的顺序是Al、Mn、Cu.
【结论应用】由于铝的活动性大于铜,铝与硫酸铜反应,所以不能用铝制容器盛装波尔多液.
故答案为:【实验过程】1、Mn的金属活动性比Al弱;1、取Mn片,插入盛有硫酸铜溶液的试管中;Mn片上由红色物质生成.
【实验结论】Al、Mn、Cu.
【结论应用】不能,铝的金属活动性大于铜,铝与硫酸铜反应.
1、由金属活动顺序表的应用可知,取Mn片,插入盛有硫酸铝溶液的试管中.没有明显现象.说明了Mn的金属活动性比Al弱;
2、为了比较Mn与Cu的活动性大小,可取Mn片,插入盛有硫酸铜溶液的试管中,现象是Mn片上由红色物质生成.说明了Mn的金属活动性比Cu强.
【实验结论】由上述实验可知,三种金属的活动性由强及弱的顺序是Al、Mn、Cu.
【结论应用】由于铝的活动性大于铜,铝与硫酸铜反应,所以不能用铝制容器盛装波尔多液.
故答案为:【实验过程】1、Mn的金属活动性比Al弱;1、取Mn片,插入盛有硫酸铜溶液的试管中;Mn片上由红色物质生成.
【实验结论】Al、Mn、Cu.
【结论应用】不能,铝的金属活动性大于铜,铝与硫酸铜反应.
点评:同学们要会利用金属活动顺序表设计实验,去验证金属的活动性强弱.氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.

练习册系列答案
 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
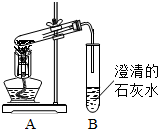 (2012?朝阳)如图是马虎同学组装的木炭还原氧化铜的实验装置图,仔细观察,找出四处错误(1)
(2012?朝阳)如图是马虎同学组装的木炭还原氧化铜的实验装置图,仔细观察,找出四处错误(1)