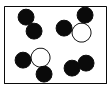
题目内容
下列符号能表示 2 个氧原子的是
A.2O B.O2- C.O D.2O2
练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
阅读下面科普短文。
苹果富含多种微量元素和维生素等人体所需的营养成分,有健脾开胃、补心益气的作用。常吃苹果还可以帮助降低胆固醇,提高免疫力。
表1 某苹果的主要营养成分(每100 g)
营养成分 | 糖类/g | 脂肪/g | 蛋白质/g | 维生素A/mg | 维生素C/mg | 钾/g | 钙/g | 铁/mg |
含量 | 16.21 | 0.17 | 0.26 | 3 | 4 | 0.12 | 0.04 | 0.6 |
食用苹果时,应避免食用果核部分。因苹果籽中含有氰苷,氰苷在人体中易转化为剧毒物质氢氰酸(HCN)。苹果加工时容易褐变,影响外观、风味,还会造成营养流失。褐变主要是由于苹果中的酚类化合物在多酚氧化酶的催化下被氧化,因此,对于苹果中多酚氧化酶的特性研究就显得尤为重要(温度对富士苹果中多酚氧化酶相对活性的影响见图)。研究发现柠檬酸能较好地抑制苹果中多酚氧化酶的相对活性。

依据文章内容,回答下列问题:
(1)苹果在加工中发生的褐变属于_____变化(填“物理”或“化学”)。
(2)在日常食用苹果时应避免食用果核,因为苹果籽中的氰苷在人体内易转化为剧毒物质_____。
(3)由图1可知,多酚氧化酶的相对活性与温度的关系是_____。
(4)加工苹果时,加入_____可以抑制苹果的褐变。
(5)下列说法中,正确的是_____(填序号)。
A 苹果营养丰富,适量食用有益健康
B 高胆固醇人群不宜食用苹果
C 表1中的钾指的是钾元素
D 苹果中维生素C的含量高于蛋白质


 ”和“
”和“ ”表示不同元素的原子,下列微观示意图能表示化合物的是( )
”表示不同元素的原子,下列微观示意图能表示化合物的是( ) B.
B.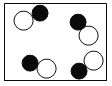 C.
C.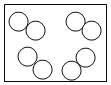 D.
D.