题目内容
 (2010?抚顺)某钙片的标签如右下图所示,同学们为测定该药片中碳酸钙的含量,取l0片钙片放入烧杯中,向烧杯中滴加稀盐酸,至不再产生气泡为止,共消耗稀盐酸42g(药片中其它成分不溶解也不参与反应),此时烧杯中剩余物质总质量为46.6g.
(2010?抚顺)某钙片的标签如右下图所示,同学们为测定该药片中碳酸钙的含量,取l0片钙片放入烧杯中,向烧杯中滴加稀盐酸,至不再产生气泡为止,共消耗稀盐酸42g(药片中其它成分不溶解也不参与反应),此时烧杯中剩余物质总质量为46.6g.计算:
(1)反应后生成二氧化碳的质量.
(2)钙片中碳酸钙的质量分数.(计算结果保留到0.1%)
分析:(2)①因钙反应中只有二氧化碳是气体,则可根据总质量守恒来计算生成二氧化碳的质量;
②根据二氧化碳的质量代入碳酸钙和盐酸反应的化学反应方程式来计算碳酸钙的质量,若碳酸钙的质量≥1.5g就属实,反之就不属实.
②根据二氧化碳的质量代入碳酸钙和盐酸反应的化学反应方程式来计算碳酸钙的质量,若碳酸钙的质量≥1.5g就属实,反之就不属实.
解答:解:(1)因每片的质量为0.68g,10片钙片的质量为0.68g×10=6.8g,
根据总质量守恒可知,
二氧化碳的质量为:42g+6.8g-46.6g=2.2g
设10片钙片中碳酸钙的质量为x
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 44
x 2.2g
=
x=5g
钙片中碳酸钙的质量分数为:
×100%═73.5%
答:二氧化碳的质量为:2.2g
钙片中碳酸钙的质量分数为73.5%
根据总质量守恒可知,
二氧化碳的质量为:42g+6.8g-46.6g=2.2g
设10片钙片中碳酸钙的质量为x
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 44
x 2.2g
| 100 |
| x |
| 44 |
| 2.2g |
x=5g
钙片中碳酸钙的质量分数为:
| 5g |
| 6.8g |
答:二氧化碳的质量为:2.2g
钙片中碳酸钙的质量分数为73.5%
点评:本题以信息为载体来考查学生分析问题并解决问题的能力,同时考查学生利用相关信息进行化学反应方程式的计算,注重了化学与生活的联系,也是以后习题的重要考查方向.

练习册系列答案
 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案
相关题目


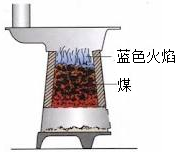 (2010?抚顺)右图为煤炉结构示意图,煤在煤炉里燃烧时会发生多个化学反应.
(2010?抚顺)右图为煤炉结构示意图,煤在煤炉里燃烧时会发生多个化学反应.