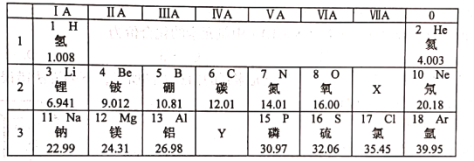
题目内容
【题目】为了了解铬与常见金属铝、铜在金属活动性顺序中的相对位置关系,进行如下探究活动。
(查阅资料)铬(Cr)是银白色有光泽的金属,在空气中表面能生成抗腐蚀性的致密氧化膜。铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液。
铝是银白色有光泽的金属,能与稀硫酸反应,生成无色的硫酸铝溶液。
(猜想)三种金属在金属活动性顺序中的相对位置关系:
①Cr Al Cu ②Al Cr Cu ③Al Cu Cr
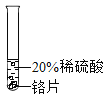
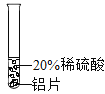
(实验过程)取大小相同的三种金属薄片,用砂纸打磨光亮。
实验一 | 实验二 | 实验三 | |
实验方案 |
|
|
|
实验现象 | 铬片表面产生气泡缓慢溶液变为蓝色 | 铝片表面产生气泡较快 | |
结论 | 铬能和稀硫酸发生反应,反应速度较慢 | 铜不与稀硫酸反应 | |
三种金属在金属活动性顺序中的相对位置关系是__________ | |||
(回答问题)(1)用砂纸打磨金属片的目的是___________________________。
(2)实验一所发生反应的化学方程式是________________________________。
(3)小清认为只要选用三种药品进行实验就可以得出三种金属在金属活动性顺序中的相对位置关系,这三种药品可以是_______________________________。
【答案】Al、Cr、Cu 去掉金属表面的氧化膜 ![]() Al、CrSO4、Cu (或Al2(SO4)3 、Cr 、CuSO4)
Al、CrSO4、Cu (或Al2(SO4)3 、Cr 、CuSO4)
【解析】
[实验过程]铬能和稀硫酸发生反应,反应速率较慢;铝片表面产生气泡较快,铝能和稀硫酸发生反应,反应速率较快;即铝、铬的金属活动性比氢强,且铝的金属活动性比铬强;铜不与稀硫酸反应,则会观察到无明显现象,说明铜的位置排在氢的后面,三种金属在金属活动性顺序中的相对位置关系是Al>Cr>Cu.
(1)金属的表面可能有与氧气反应生成的氧化物或污物,用砂纸打磨金属片,其目的是除去金属片表面的氧化膜或污物.
(2)实验一铬与稀硫酸反应生成硫酸铬和氢气,反应的化学方程式为:![]() .
.
(3)在验证三种金属活动性强弱时,通常采取“三取中”的方法,即取中间金属单质与两端的金属的盐溶液反应或取中间金属的盐溶液与两端金属的单质反应,因此可选用Al、CrSO4溶液、Cu或Al2(SO4)3 、Cr 、CuSO4等。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案