题目内容
【题目】小明在老师的指导下测一瓶稀盐酸的溶质质量分数,具体步骤如下:
步骤一:配制溶质质量分数为10%的氢氧化钠溶液。
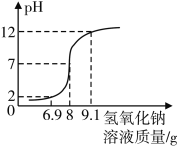
步骤二:向20 g待测稀盐酸中逐滴滴入上述氢氧化钠溶液,并使用pH计记录溶液的pH变化情况,绘制图象如图。
(1)在往稀盐酸中逐渐滴入氢氧化钠溶液的过程中,当溶液的pH达到2时,溶液中的溶质有___。(用化学式表示)
(2)请结合图,计算该稀盐酸的溶质质量分数__________。(结果精确到0.01%)
【答案】NaCl、HCl 3.65%。
【解析】
(1)根据盐酸和氢氧化钠溶液反应生成氯化钠和水,当溶液的pH达到2,溶液显酸性,说明盐酸还有剩余,所以溶液中的溶质有HCl和NaCl进行解答;
(2)根据溶液的pH等于7时恰好完全反应消耗氢氧化钠溶液的质量为8g,求出该稀盐酸的溶质质量分数即可。
解:(1)当溶液的pH达到2时,说明溶液显酸性,盐酸有剩余,所以溶液中的溶质有NaCl、HCl;
(2)溶液的pH等于7时恰好完全反应消耗氢氧化钠溶液的质量为8g,
设该稀盐酸的溶质质量分数为x,
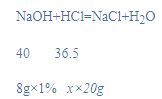
![]()
x=0.365%;
答:该稀盐酸的溶质质量分数为0.365%。

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目