题目内容
某校化学实验室废液桶中收集了溶解大量FeSO4、CuSO4的废水,若直接排放到下水道不仅造成重金属污染而且造成浪费.初三某班的同学,准备运用刚学到的“常见金属活动性顺序表”结合其他有关化学知识对废水进行处理.
(1)回忆常见金属活动顺序表,在下表空格中分别填入对应的元素符号.

(2)设计除去铜离子,回收硫酸亚铁晶体和铜的实验方案,讨论有关问题:
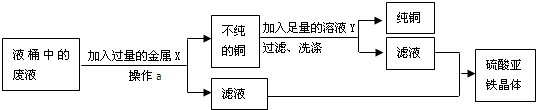
①操作a的名称是: ,进行操作a使用玻璃棒的作用是 .
②金属X是 (填化学式,下同),有关反应的化学方程式为 .溶液Y是 ,利用其除去铜中杂质,有关反应的化学方程式为 .
(1)回忆常见金属活动顺序表,在下表空格中分别填入对应的元素符号.

(2)设计除去铜离子,回收硫酸亚铁晶体和铜的实验方案,讨论有关问题:

①操作a的名称是:
②金属X是
分析:(1)根据金属活动性顺序表的内容,在空格中填入金属元素的符号.
(2)①依据混合物分离的方法分析判断操作A,根据玻璃棒的应用分析其作用;
②由于目的是获得铜单质和硫酸亚铁,所以需要将铜离子转化为铜单质,而溶液中需要的是硫酸亚铁而不能引入新的杂质,所以加入的能够将铜离子转化为铜单质的只能是单质铁;由于加入的铁是过量的,需要加入过量稀硫酸除去铜中的铁.据此分析回答.
(2)①依据混合物分离的方法分析判断操作A,根据玻璃棒的应用分析其作用;
②由于目的是获得铜单质和硫酸亚铁,所以需要将铜离子转化为铜单质,而溶液中需要的是硫酸亚铁而不能引入新的杂质,所以加入的能够将铜离子转化为铜单质的只能是单质铁;由于加入的铁是过量的,需要加入过量稀硫酸除去铜中的铁.据此分析回答.
解答:解:(1)由金属活动性顺序表的内容可知,介于Zn、Sn之间的是Fe;介于H、Hg之间的是Cu;介于Hg、Pt之间的是Ag.故填入下表如下:
(2)①过滤是将不溶性固体从溶液中分离出来的操作,所以由图示可知,该操作应该是过滤;在进行过滤时,使用玻璃棒的作用是引流.
②为回收废液中的Cu2+,需加入活动性在铜前面的金属进行置换,但要得到较为纯净FeSO4的溶液,只能向废液中加入过量的铁粉与硫酸铜发生置换反应,生成物中只有硫酸亚铁,加入其它金属溶液中又混有其它溶质.所以,金属X是Fe,反应的化学方程式为:Fe+CuSO4=FeSO4+Cu.由于有过量铁粉,为除去混在铜粉里的铁粉并且得到FeSO4溶液,把金属混合物放入足量的稀硫酸并过滤即可.所以,溶液Y是H2SO4,反应的方程式是:Fe+H2SO4=FeSO4+H2↑.
故答为:(1);见上表;(2)①过滤,引流;②Fe,Fe+CuSO4=FeSO4+Cu、H2SO4、Fe+H2SO4=FeSO4+H2↑.

(2)①过滤是将不溶性固体从溶液中分离出来的操作,所以由图示可知,该操作应该是过滤;在进行过滤时,使用玻璃棒的作用是引流.
②为回收废液中的Cu2+,需加入活动性在铜前面的金属进行置换,但要得到较为纯净FeSO4的溶液,只能向废液中加入过量的铁粉与硫酸铜发生置换反应,生成物中只有硫酸亚铁,加入其它金属溶液中又混有其它溶质.所以,金属X是Fe,反应的化学方程式为:Fe+CuSO4=FeSO4+Cu.由于有过量铁粉,为除去混在铜粉里的铁粉并且得到FeSO4溶液,把金属混合物放入足量的稀硫酸并过滤即可.所以,溶液Y是H2SO4,反应的方程式是:Fe+H2SO4=FeSO4+H2↑.
故答为:(1);见上表;(2)①过滤,引流;②Fe,Fe+CuSO4=FeSO4+Cu、H2SO4、Fe+H2SO4=FeSO4+H2↑.
点评:金属活动顺序表是解决与金属相关变化的重要工具,表中H元素为标志性参考元素,H之前为活泼金属,H之后金属性质不活泼.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目








