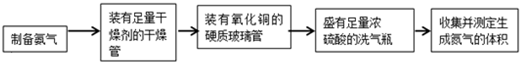
题目内容
请回答下列问题(在下列(1)(2)两小题中任选一题回答,若两题都回答,则以第一题的答案来评定分数).
(1)请举出两例生活中常见的缓慢氧化现象.
(2)鉴别厨房中的白酒和白醋.
(1)请举出两例生活中常见的缓慢氧化现象.
(2)鉴别厨房中的白酒和白醋.
分析:(1)在日常生活中缓慢氧化现象较多,缓慢氧化就是氧化反应进行的很缓慢,甚至不易觉察的氧化反应.
(2)利用两种物质物理性质的差异进行鉴别方法的设计,两液体的气味、味道不同,可用于鉴别两液体;
也可利用两液体的化学性质的不同,选取在家庭厨房使用的物质进行鉴别;白醋含有醋酸,能与纯碱反应放出二氧化碳,而白酒含酒精,不能与纯碱发生反应.
(2)利用两种物质物理性质的差异进行鉴别方法的设计,两液体的气味、味道不同,可用于鉴别两液体;
也可利用两液体的化学性质的不同,选取在家庭厨房使用的物质进行鉴别;白醋含有醋酸,能与纯碱反应放出二氧化碳,而白酒含酒精,不能与纯碱发生反应.
解答:解:(1)生活中常见的缓慢氧化
①酒和醋的酿造过程中通常要发生氧化反应,该种氧化反应比较缓慢,属于缓慢氧化;
②农家肥料的腐熟过程中通常要发生氧化反应,该种氧化反应比较缓慢,属于缓慢氧化;
(2)白醋有酸味,白酒有酒香味,可取少量样品,品偿,有酸味的是白醋,没有酸味的是白酒.(也可闻)进行鉴别;白醋能与碳酸钠反应产生气泡,白酒不能;可以取样,加入纯碱粉末(或小苏打),有气泡产生的则为白醋,没有气泡产生的是白酒.(也可用燃烧法)进行鉴别
故答案为:(1)酒和醋的酿造,农家肥料的腐熟
(2)取少量样品,品偿,有酸味的是白醋,没有酸味的是白酒
或取样,加入纯碱粉末(或小苏打),有气泡产生的则为白醋,没有气泡产生的是白酒.(也可用燃烧法)
①酒和醋的酿造过程中通常要发生氧化反应,该种氧化反应比较缓慢,属于缓慢氧化;
②农家肥料的腐熟过程中通常要发生氧化反应,该种氧化反应比较缓慢,属于缓慢氧化;
(2)白醋有酸味,白酒有酒香味,可取少量样品,品偿,有酸味的是白醋,没有酸味的是白酒.(也可闻)进行鉴别;白醋能与碳酸钠反应产生气泡,白酒不能;可以取样,加入纯碱粉末(或小苏打),有气泡产生的则为白醋,没有气泡产生的是白酒.(也可用燃烧法)进行鉴别
故答案为:(1)酒和醋的酿造,农家肥料的腐熟
(2)取少量样品,品偿,有酸味的是白醋,没有酸味的是白酒
或取样,加入纯碱粉末(或小苏打),有气泡产生的则为白醋,没有气泡产生的是白酒.(也可用燃烧法)
点评:此题考查生活中的缓慢氧化及生活中物质的鉴别,使学生明白,生活中处处有化学,学化学就是服务于生活实践,也提倡学生做学化学、用化学的有心人.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
乙醇(C2H5OH)是以高梁、玉米、薯类等为原料,经过发酵、蒸馏制得,属于可再生资源.乙醇在足量的氧气中完全燃烧时生成二氧化碳和水,如果氧气不足,乙醇燃烧可能还有一氧化碳生成.现用下图实验装置进行实验,检验乙醇的燃烧产物中是否有二氧化碳和一氧化碳:(友情提示:CO+CuO
CO2+Cu)

请回答下列问题:
(1)写出乙醇在足量的氧气中完全燃烧的化学方程式 .
(2)有甲、乙、丙三个同学分别完成上述实验并将观察到的现象填写在下表中,试用“有”、“没有”和“可能有”填写下表中的实验结论.
(3)若燃烧一定量的乙醇,得到了4.4g二氧化碳和5.6g一氧化碳,在该反应过程中生成水的质量是 .
| ||

请回答下列问题:
(1)写出乙醇在足量的氧气中完全燃烧的化学方程式
(2)有甲、乙、丙三个同学分别完成上述实验并将观察到的现象填写在下表中,试用“有”、“没有”和“可能有”填写下表中的实验结论.
| 实验现象 | 实验结论 | ||||
| A装置 | C装置 | E装置 | 是否有二氧化碳 | 是否有一氧化碳 | |
| 甲同学 | 石灰水 变浑浊 |
石灰水 没变浑浊 |
石灰水 没变浑浊 |
||
| 乙同学 | 石灰水 变浑浊 |
石灰水 变浑浊 |
石灰水 变浑浊 |
||
| 丙同学 | 石灰水 没变浑浊 |
石灰水 没变浑浊 |
石灰水 变浑浊 |
||
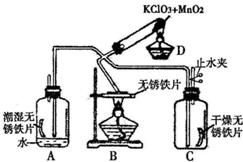 33、为了验证铁与氧气在不同条件下的反应情况,设计如图所示(部分铁架台已略去)的实验,D装置是O2发生装置,A为铁在有水存在下与O2反应装置,B为无锈铁片在加热条件下与O2反应装置,C装置是验证在干燥条件下O2与铁反应装置(C装置事先干燥过).请回答下列问题:
33、为了验证铁与氧气在不同条件下的反应情况,设计如图所示(部分铁架台已略去)的实验,D装置是O2发生装置,A为铁在有水存在下与O2反应装置,B为无锈铁片在加热条件下与O2反应装置,C装置是验证在干燥条件下O2与铁反应装置(C装置事先干燥过).请回答下列问题: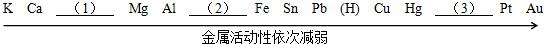
 (2013?荆门)某化学兴趣小组使用右图所示装置,对某种铁铜合金的成分进行测量.先取足量稀硫酸于烧杯中,再向其中加入14.0g合金样品开始计时,并将电子天平的读数记录在下表中,请回答下列问题:
(2013?荆门)某化学兴趣小组使用右图所示装置,对某种铁铜合金的成分进行测量.先取足量稀硫酸于烧杯中,再向其中加入14.0g合金样品开始计时,并将电子天平的读数记录在下表中,请回答下列问题: