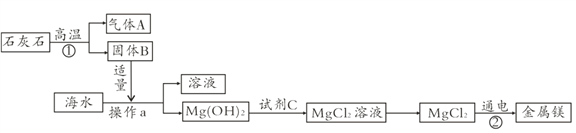
题目内容
【题目】高纯氧化铁可作现代电子工业的材料。以下是以硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2)为原料制备高纯氧化铁(Fe2O3)的生产流程图。
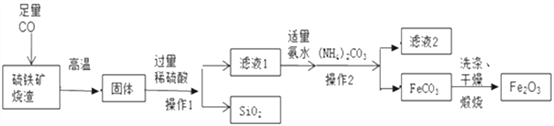
(1)实验室中,操作1、操作2用到的玻璃仪器有玻璃棒、烧杯、_____等。
(2)滤液1中主要的阳离子是 ______________。(写2种)
(3)滤液1中加氨水要适量,若氨水不足,则硫酸不能完全反应;若氨水过量,则__________________。
(4)滤液2中可回收的产品是____________(写化学式)。
(5)写出在空气中煅烧FeCO3的化学反应方程式______________________________
【答案】 漏斗 Fe2+、H+ 会生成Fe(OH)2(或Fe(OH)3) (NH4)2SO4 4FeCO3+O2![]() 2Fe2O3+4CO2
2Fe2O3+4CO2
【解析】(1)据图可以看出,经过操作Ⅰ、操作Ⅱ得到的是滤液和固体,故是过滤操作,用到的玻璃仪器有玻璃棒、烧杯、漏斗;
(2)一氧化碳能将氧化铁还原为铁,将氧化亚铁还原为铁,故硫铁矿高温通入一氧化碳得到的固体中主要含有的是铁,稀硫酸能与铁反应生成硫酸亚铁和氢气,故含有亚铁离子,由于硫酸过量,故含有氢离子,滤液Ⅰ中主要的阳离子是亚铁离子和氢离子,化学符号为:Fe2+、H+;
(3)由于硫酸过量,溶液呈酸性,氨水呈碱性,若氨水过量,会生成Fe(OH)2或Fe(OH)3;
(4)碳酸铵能与硫酸亚铁反应生成碳酸亚铁和硫酸铵,故滤液Ⅱ中可回收的产品是硫酸铵,化学式为:(NH4)2SO4;
(5)在空气中煅烧FeCO3生成氧化铁和二氧化碳,反应的化学方程式是:4FeCO3+O2![]() 2Fe2O3+4CO2。
2Fe2O3+4CO2。

【题目】硫酸铜是一种应用极其广泛的化工原料,易溶于水而不易溶于酒精;铜离子完全沉淀的pH是5左右,铁离子完全沉淀的pH是2左右。以下是某工厂用含铁废铜为原料生产胆矾(CuSO4·5H2O)和副产物石膏(CaSO4·2H2O)的生产流程示意图:

胆矾和石膏在不同温度下的溶解度(g/100g水)如表。
温度(℃) | 20 | 40 | 60 | 80 | 100 |
石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
请回答下列问题:
(1)红褐色滤渣的主要成分是____________;
(2)铜和稀硝酸反应的化学方程式3Cu+8HNO3=_____________+2NO↑+4H2O;
(3)石灰浆调pH大约要调节到___________
A. 2 B. 5 C. 7 D. 10
(4)操作I最后温度应该控制在___________℃左右;
(5)从溶液中分离出硫酸铜晶体的操作Ⅱ应为蒸发浓缩、_______、过滤、洗涤、干燥;晶体用无水乙醇作洗涤液而不用蒸馏水的原因是__________________________。