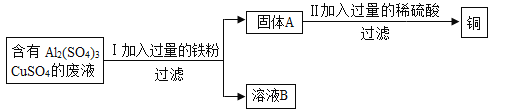
题目内容
【题目】下图为A、B、C三种物质的溶解度曲线,据图回答:
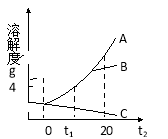
(1)t2℃时,A、B、C三种物质的溶解度由大到小顺序是 。
(2)将t2℃时三种物质等质量的饱和溶液分别降温到0℃时,析出晶体最多的是 。
(3)20℃时,将50gA物质放入100g水中,充分搅拌,所得溶液的质量是 g。
(4)若将t1℃三种物质的饱和溶液分别升温到t2℃时,则三种溶液中溶质的质量分数最大的是 。
(5)A中混有少量的B,要得到较纯净的A,可采用的方法是 。
【答案】(1)A>B>C (2)A (3)140 (4)B (5)降温结晶
【解析】
试题分析:(1)根据溶解度曲线,t2℃时,A、B、C三种物质的溶解度由大到小顺序是:A>B>C
(2)根据溶解度曲线,三种物质的溶解度,A物质的溶解度随温度的升高变化最大,故将t2℃时三种物质等质量的饱和溶液分别降温到0℃时,析出晶体最多的是A
(3)根据溶解度曲线,20℃时,A物质的溶解度为40g,故将50gA物质放入100g水中,充分搅拌,所得溶液的质量=40s+100g=140g
(4)根据溶解度曲线,A、B物质的溶解度都随温度的升高而增大,故将t1℃A、B物质的饱和溶液分别升温到t2℃时,由饱和变为不饱和溶液,溶液的溶质质量分数不变,而在t1℃,A物质的溶解度小于B物质的溶解度,故溶质质量分数B更大,而C的溶解度随温度的升高而降低,故它再升温过程中有晶体析出,所以三种溶液中溶质的质量分数最大的是B
(5)根据溶解度曲线,A物质的溶解度都随温度的升高而增大的趋势比B物质要更大,故A中混有少量的B,要得到较纯净的A,可采用的方法是降温结晶

【题目】某化学兴趣小组在探究稀盐酸的化学性质时,做了如图一所示的三个实验.

(1)写出A试管中的反应现象 ;
(2)写出B试管中反应的化学方程式 ;
(3)实验结束后,小组同学将B、C两支试管中的废液同时倒入一个洁净的烧杯中,观察到先有气泡产生,后有白色沉淀生成.同学们将烧杯内的物质进行过滤,对所得滤液的溶质成分进行探究.
【提出猜想】
甲同学猜想:NaCl; 乙同学猜想:NaCl、CaCl2;丙同学猜想:NaCl、CaCl2、HCl;
你的猜想: ;
【交流讨论】你认为 同学的猜想一定不正确,理由是 ;
【设计实验】请设计实验证明你的猜想正确.
实验步骤 | 实验现象 | 实验结论 |
取少量滤液于试管中,向其中滴加 | 猜想成立 |