题目内容
某同学用一小块铝片和盐酸反应制取H2,实验现象如下表:
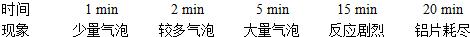
反应1~15min内,铝与盐酸的反应速率变化的可能原因是( )
反应1~15min内,铝与盐酸的反应速率变化的可能原因是( )
分析:由实验现象知反应在1~15min内是由缓慢到剧烈再到反应完毕,反应加快的原因有温度的升高,反应物浓度的增加,接触面积的增加,催化剂的使用等.仔细分析四个选项,不难排除B、C、D选项.
解答:解:用排除法:B反应过程中盐酸浓度减小而不是增大;C铝片表面积变小应该是反应减慢而从现象看是反应速度加快;D中盐酸溶液中氯离子与氢离子是分开存在的,反应过程中Cl-离子没有变化,若是反应的催化剂应该是反应速度始终不变.
故选A
故选A
点评:本题通过对化学反应速率变化原因的分析,考察了学生通过分析实验现象得出本质原因的能力;重点在于考察不可能原因的排除.

练习册系列答案
相关题目