题目内容
【题目】室温时,向盛有18.6g碳酸钠和氢氧化钠混合粉末的烧杯中加入100g稀盐酸,恰好完全反应,得到114.2g该温度下的不饱和溶液,则下列判不正确的是( )
A. 生成CO2为4.4g
B. 原固体混合物中钠元素为9.2g
C. 所得溶液中溶质的质量为23.4g
D. 所加稀盐酸的溶质质量分数为7.3%
【答案】D
【解析】
根据质量守恒定律可得,生成的二氧化碳的质量为18.6g+100g﹣114.2g=4.4g
设碳酸钠的质量为x,生成的氯化钠的质量为z

x=10.6g
z=11.7g
则氢氧化钠的质量为18.6g﹣10.6g=8g
原固体混合物中钠元素为![]() ×
×![]() ×8g=9.2g
×8g=9.2g
生氯化钠的总质量为a。消耗的HCl的总质量为b
则根据钠元素守恒和氯元素守恒可得关系式为
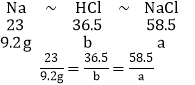
a=23.4g
b=14.6g
所加稀盐酸的溶质质量分数为![]() ×100%=14.6%而非7.3%
×100%=14.6%而非7.3%
故选:D。

 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案【题目】铁、铝、铜是常见的三种金属。生活中的铝制品和铜器表面一般不用防锈,而铁制品则需防锈处理。
(提出问题)这三种金属的活动性强弱到底如何呢?
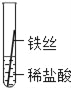
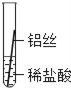
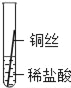
(实验探究)同学们将粗细相同的铁丝、铝丝、铜丝分别插入等体积、等浓度的稀盐酸溶液中:
操作 |
|
|
|
片刻后现象 | 缓慢产生少量气泡 | 无气泡 | 无气泡 |
几分钟后现象 | 缓慢产生少量气泡 | 快速产生大量气泡 | 无气泡 |
(讨论交流)
分析上述现象,得出三种金属的活动性由强到弱的顺序是_____。
铝丝插入稀盐酸的实验中,请你分析随着时间变化而出现的现象,并猜测该过程中还发生了什么反应?_____。(用文字叙述)
(反思改进)氧化铝与稀盐酸反应
做验证金属的性质实验前,需对金属进行怎样的处理?_____。
有同学提出“只用一支盛有少量稀盐酸的试管,只需调整金属丝的插入顺序,也能证明三种金属的活动性顺序”。则金属丝的插入顺序可以为_____(填一种顺序即可)。
(拓展迁移)将一定质量的铝粉放入含有硫酸亚铁、硫酸铜的混合溶液中,充分反应后,过滤。向滤出的固体中滴加稀硫酸,发现有气泡产生。
滤液中一定含有的溶质是_____(填化学式)。
该过程中产生气体时,一定发生的反应的方程式为_____。