题目内容
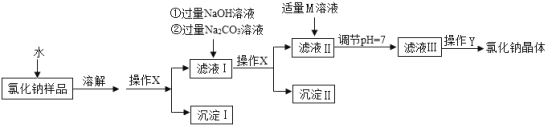
【题目】(10分)氯化钠是日常生活中的必需品。某氯化钠样品中除含氯化钠外,还含有少量的CaCl2、MgCl2以及不溶性杂质。以下是提纯该样品的流程图。
请回答:
(1)操作X中,需要用到的玻璃仪器有烧杯、玻璃棒、 。
(2)加入NaOH溶液可除去的阳离子是 (填离子符号),反应的化学方程式为 。
(3)加入Na2CO3溶液的目的是 ,反应的化学方程式为 。
(4)M的化学式为 。
(5)操作Y中要用到玻璃棒,其作用是 。
(6)农业上常要用质量分数为16%的氯化钠溶液选种,现配制100kg这种溶液,需氯化钠 Kg,取50g该溶液稀释成质量分数为8%的氯化钠溶液,需加水的质量 g。配制时,需用到的玻璃仪器有烧杯、滴管、玻璃棒、 。
【答案】(1)漏斗
(2)Mg2+、2NaOH+MgCl2 == Mg(OH)2↓ + 2NaCl
(3)除去滤液中的CaCl2 (或Ca2+),Na2CO3 + CaCl2 == CaCO3↓ + 2NaCl
(4)HCl
(5)防止液滴飞溅
(6)16, 50, 量筒
【解析】
试题分析:(1)通过操作X得到了固体和液体,说明该操作是过滤,过滤时需要的仪器有:铁架台、漏斗、玻璃棒、烧杯;
(2)氢氧化钠会与氯化镁反应生成氢氧化镁沉淀:2NaOH+MgCl2 == Mg(OH)2↓ + 2NaCl,故除去的阳离子是镁离子;
(3)氯化钠中含有氯化钙,加入碳酸钠的目的就是除去氯化钙,氯化钙与碳酸钠反应生成的是碳酸钙沉淀和氯化钠:Na2CO3 + CaCl2 == CaCO3↓ + 2NaCl;
(4)由于加入的碳酸钠是过量的,故要把碳酸钠中的碳酸根离子除去,那么可加入稀盐酸,稀盐酸与碳酸钠反应生成的氯化钠、水和二氧化碳;
(5)通过操作Y得到了氯化钠晶体,那么操作Y是蒸发,蒸发时需要玻璃棒不断的搅拌,目的是使液体受热均匀,防止液滴飞溅;
(6)氯化钠溶液中溶质氯化钠的质量=100kg×16%=16kg,溶液的稀释过程中溶质的质量不变,设稀释后溶液的质量为x,50g×16%=8%x,x=100g,配制溶液时需要的仪器有烧杯、滴管、玻璃棒和量筒。

【题目】学会用化学解决生活问题是学习化学的一项重要任务.下列物质鉴别方法错误的一组是
A. 白酒和白醋──闻气味
B. 软水和硬水──肥皂水
C. N2和CO2──燃着的木条
D. 空气和氧气──带火星的木条
【题目】把一定质量的a,b,c,d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下,下列说法中正确的是
物 质 | a | b | c | d |
反应前的质量(g) | 6.4 | 3.2 | 4.0 | 2.8 |
反应后的质量(g) | 5.2 | X | 7.2 | 2.8 |
A.a和c是反应物 B.d一定是催化剂
C.X=2.0 D.该反应是化合反应