题目内容
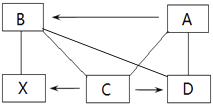
【题目】某金属加工厂有大量金属铝、铁、铜的废弃粉末,为充分利用金属资源,分离
和回收金属,某化学兴趣小组通过查阅资料设计了如下实验方案:
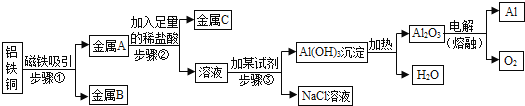
请完成下列各题:
(1)步骤①中分离得到的金属B是 。
(2)步骤②中所需的主要操作是 。
(3)步骤③生成沉淀的化学反应方程式是 ;
因Al(OH)3既能与酸反应又能与碱反应,步骤③逐滴加入试剂至 为止。
(4)电解熔融Al2O3制金属铝的化学方程式是 。
【答案】⑴铁(或Fe)
⑵置换反应
⑶3NaOH+AlCl3=Al(OH)3↓+3NaCl 逐滴滴加氢氧化钠溶液至沉淀完全(或加入适量的氢氧化钠溶液,注:描述中要有控制速度或适量含意)
⑷2Al2O3(熔融)![]() 4Al+3O2↑(未标“熔融”不扣分)
4Al+3O2↑(未标“熔融”不扣分)
【解析】
试题分析:(1)磁铁能将铁吸出,故金属B为铁;(2)金属A为铝和铜的混合物,加入稀盐酸,铝与稀盐酸反应生成氯化铝和氢气,由一种单质和一种化合物反应生成另一种单质和另一种化合物,故反应属于置换反应;(3)步骤②中生成的溶液是氯化铝溶液,它和氢氧化钠反应生成氢氧化铝和氯化钠,反应的化学方程式为:3NaOH+AlCl3=Al(OH)3↓+3NaCl;因为Al(OH)3既能与酸反应又能与碱反应,步骤③加入试剂时应避免氢氧化钠过量,故应逐滴滴加氢氧化钠溶液至沉淀完全;
(4)熔融的三氧化二铝电解生成金属铝和氧气,反应的化学方程式为:2Al2O3(熔融)![]() 4Al+3O2↑;
4Al+3O2↑;

练习册系列答案
相关题目