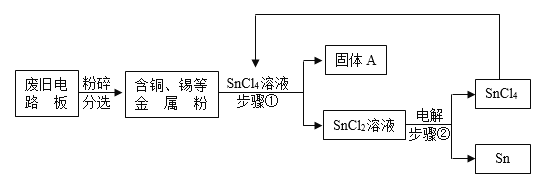
题目内容
【题目】2.3g某物质在空气中完全燃烧,生成4.4g二氧化碳和2.7g水,则该物质中一定含有 元素(填元素符号),其质量比为 .
【答案】C、H、O;12:3:8.
【解析】
试题先根据反应前后元素的种类不变,确定:该物质中一定含有碳、氢两种元素,可能含有氧元素.再根据反应前后元素的质量相等,来确定氧元素是否含有.
二氧化碳中碳的质量为:4.4g×![]() ×100%=1.2g;
×100%=1.2g;
水中氢的质量为:2.7g×![]() ×100%=0.3g;
×100%=0.3g;
碳元素与氢元素质量之和为1.2g+0.3g=1.5g;
由于1.5g<2.3g,所以该物质中一定含有氧元素,且含有氧的质量为2.3g﹣1.5g=0.8g.
故可判断该化合物中一定含有C、H、O元素,质量比为:1.2g:0.3g:0.8g=12:3:8.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目