题目内容
【题目】M是生活中常见的金属,MSO4溶液是无色液体,某化学兴趣小组的同学欲探究M与铜、铝的活动性顺序,请你和他们一起进行以下探究活动. 【提出问题】M、铜、铝的金属活动性顺序是怎样的?
(1)【猜想与假设】小敏的猜想是Al>Cu>M;小强的猜想是Al>M>Cu;你的猜想是 . 【设计与实验】为了探究三种金属的活动性顺序,同学们取粗细相同的M丝、铝丝及相关溶液,进行了如图所示的实验:
观察到只有试管乙中发生明显变化,那么试管乙中观察到的现象是 .
【交流与表达】同学们一致认为试管丙中也应该有明显变化,之所以出现这种情况的原因可能是 .
于是同学们对实验进行了改进,把甲、丙中的铝丝打磨干净后又分别插入原试管中,结果甲、丙试管中都出现了明显变化,则丙试管中发生反应的化学方程式为 .
(2)【解释与结论】通过以上实验,同学们得出了三种金属的活动性顺序. 【评价与反思】实验结束后,同学们对实验过程进行了如下反思:
同学们经过讨论后认为该实验可以优化,去掉试管(填试管编号)中的实验,也可以得出正确的结论.
除了上述实验外,还可以将铝丝、铜丝分别插入到盛有溶液的试管中,或将(填一种物质)分别插入到硫酸铝、硫酸铜溶液中,根据实验现象进行判断.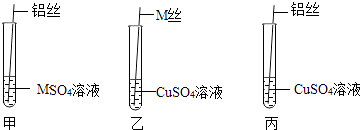
【答案】
(1)M>Al>Cu;M表面出现一层红色物质;铝丝表面有氧化铝保护膜阻止反应的进行;2Al+3CuSO4=Al2(SO4)3+3Cu
(2)丙;MSO4;M丝
【解析】解:【提出问题】通过分析小敏、小强同学的猜想可知,我的猜想是M>Al>Cu;故填:M>Al>Cu;【设计与实验】M的金属活动性大于铜的金属活动性,所以试管乙中观察到的现象是:M表面出现一层红色物质;故填:M表面出现一层红色物质;【交流与表达】试管丙中使用的是铝丝,没有明显变化可能是因为铝丝表面有氧化铝保护膜阻止反应的进行,故填:铝丝表面有氧化铝保护膜阻止反应的进行.(2)丙试管中铝与硫酸铜反应生成硫酸铝和铜,发生反应的化学方程式为,故填:2Al+3CuSO4=Al2(SO4)3+3Cu.【评价与反思】可以去掉试管丙中的实验,得出正确的结论,故填:丙.要验证三种金属的活动性顺序,可以采用三取其中的方法,故除了上述实验外,还可以将铝丝、铜丝分别插入到盛有MSO4溶液的试管中,或将M丝分别插入到硫酸铝、硫酸铜溶液中.故填:MSO4;M丝.
【考点精析】利用书写化学方程式、文字表达式、电离方程式对题目进行判断即可得到答案,需要熟知注意:a、配平 b、条件 c、箭号.