题目内容
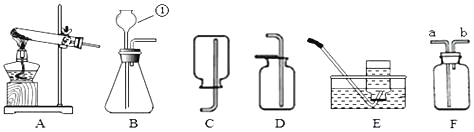
【题目】下图是实验室常见的装置。
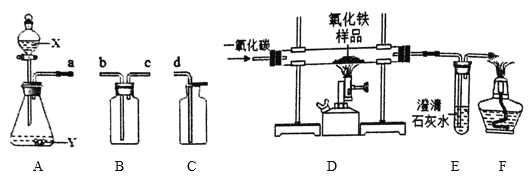
(1)写出A装置中任一仪器的用途:_____。
(2)若用A装置制取氧气,则A中发生反应的化学方程式为_____;若用装满水的B装置收集氧气,a端应与_____(选填“b”或“c”)端相连。
(3)若用ABC装置制取并收集一瓶干燥CO2,则试剂X的名称是_____,B装置中盛放适量的浓硫酸,导管的连接顺序为a→_____→_____→d。
(4)利用DEF装置测定某不纯氧化铁样品的纯度(杂质不参与反应),并验证气体生成物的性质。
①装置F的作用是_____。
②若氧化铁样品质量为20g,反应后D装置的质量减少4.8g,则该样品中氧化铁的纯度为_____。
【答案】锥形瓶常用作反应容器 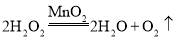 c 稀盐酸 b c 处理尾气一氧化碳,防止污染空气 80%
c 稀盐酸 b c 处理尾气一氧化碳,防止污染空气 80%
【解析】
制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热。氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集。实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热。二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集。
(1)A装置中锥形瓶常用作反应容器(合理即可);
(2)若用A装置制取氧气,属于固液混合不加热型装置,应选用过氧化氢和二氧化锰反应制氧气,则A中发生反应的化学方程式为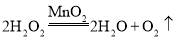 ;若用装满水的B装置收集氧气,氧气不易溶于水且密度比水小,a端应与c端相连,水从b端排出;
;若用装满水的B装置收集氧气,氧气不易溶于水且密度比水小,a端应与c端相连,水从b端排出;
(3)实验室常用石灰石和稀盐酸反应生成氯化钙和水和二氧化碳的反应制取二氧化碳,二氧化碳能和氢氧化钠反应,不和浓硫酸反应,常用浓硫酸干燥二氧化碳气体,二氧化碳密度比空气大且可溶于水,用向上排空气法收集,若用ABC装置制取并收集一瓶干燥CO2,则试剂X的名称是稀盐酸,B装置中盛放适量的浓硫酸,导管的连接顺序为a→b→c→d;
(4)利用DEF装置测定某不纯氧化铁样品的纯度(杂质不参与反应),并验证气体生成物的性质。
①一氧化碳有毒,会污染空气,装置F的作用是处理有毒的尾气一氧化碳,防止污染空气;
②若氧化铁样品质量为20g,反应后D装置的质量减少4.8g,则减少的质量是氧元素的质量=4.8g,那么氧化铁的质量=4.8g÷![]() =16g,则该样品中氧化铁的纯度为
=16g,则该样品中氧化铁的纯度为![]() =80%。
=80%。

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案【题目】下列实验方案不能达到实验目的是( )
序号 | A | B | C | D |
目的 | 证明二氧化碳溶于水且能和水反应 | 证明碳与氧化铜能发生反应 | 探究同种溶质在不同的溶剂的溶解性 | 探究燃烧的条件是燃烧需要氧气 |
方案 |
|
|
|
|
A. AB. BC. CD. D
【题目】某化学兴趣小组为探究化学反应中的能量变化,进行如下实验:
探究一:盐酸与氢氧化钠的反应
(1)甲同学设计实验:向一定量氢氧化钠固体中加入20mL4%盐酸,用温度计反应后溶液温度升高,得出中和反应放热。乙同学认为该实验方案不合理,其理由是_____。
(2)丙同学设计了如下三组实验,请你帮助他完成实验方案:
实验编号 | 实验方案 |
实验1 | 向20mL4%盐酸中加入20mL水,测定稀释前后溶液的温度。 |
实验2 | 向20mL5%氢氧化钠溶液中_____,测定稀释前后溶液的温度。 |
实验3 | _____ |
(3)丙同学观察到的实验现象是:实验3溶液升高的温度远大于实验1与实验2溶液升高的温度之和,由此你能得出的实验结论是_____。
探究二:盐酸与碳酸氢钠溶液的反应
下图是丁同学在20、基本隔热条件下利用温度传感器,绘制分别向20mL水和20mL饱和碳酸氢钠溶液中各加入20mL13.7%盐酸的温度与时间的变化曲线图。实验测得饱和碳酸氢钠溶液稀释时温度变化不大,可忽略不计。据此回答下列问题:

曲线①:水+盐酸的温度变化曲线;曲线②:饱和碳酸氢钠溶液+盐酸的温度变化曲线
(4)26秒后,曲线①逐渐下降的主要原因是_____。
(5)曲线②反应的化学方程式是_____。
(6)比较曲线①和曲线②,你认为13.7%盐酸与饱和碳酸氢钠溶液的反应是_____(填“放热”或“吸热”)反应,其理由是_____。