题目内容
【题目】根据下图回答问题:
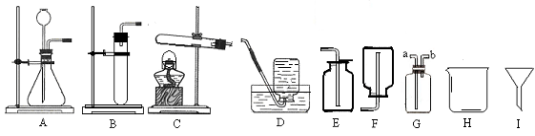
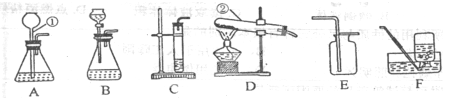
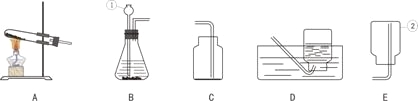
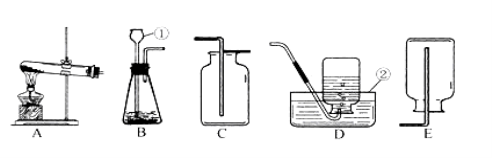
(1)指出下列编号仪器的名称:H 、I ;
(2)实验室制取和收集CO2时应选用 两种装置相连接,检验集气瓶中CO2是否收集满的方是 .
A与B相比,优点是 .
(3)实验室用KMnO4制取O2发生装置选 ,该反应的方程式为 ,装药品前应进行的操作是______ ____,用D装置收集O2,如何判断气体已收集满: .实验停止时的操作顺序是 .
(4)若用C装置进行木炭还原氧化铜实验,酒精灯需加一个金属网罩,其目的是 .反应的方程式为 .
(5)若用装置F收集某气体,该气体应具备的性质是 .
(6)氨气(NH3)是一种无色、有刺激性气味,密度比空气小,极易溶于水的气体,其水溶液俗称氨水。某课外兴趣小组同学用加热氯化铵和消石灰的固体混合物制取氨气,他们应选择的发生装置是 ,若选用G装置收集氨气,应从 (选填“a”或“b”)通入.
(7)小强称取12.5 g石灰石(主要成分是CaCO3,杂质不参加反应)放人烧杯中,向其中加入50g稀盐酸,二者恰好完全反应。反应结束后称量烧杯中剩余物质的总质量为58.1 g(不包括烧杯的质量,且气体的溶解忽略不计) .试计算石灰石中碳酸钙的质量分数.
【答案】(1)烧杯 漏斗;
(2)AE或BE,用燃烧的木条放在瓶口处观察,火焰熄灭证明收集满,A具有控制药品用量的优势;
(3)C 2KMnO4 △K2MnO4 + MnO2 + O2↑, 检查气密性, 气泡从集气瓶口处逸出, 导管移除水面;
(4)集中加热,达到高温 C + 2CuO 高温 2Cu + CO2↑;
(5)密度比空气小 ,不与空气反应;
(6)C b ;
(7)解:根据质量守恒定律可知,二氧化碳的质量为12.5g +50g-58.1g=4.4g;
设碳酸钙的质量分数为x
CaCO3 + 2HCl =CaCl2 + CO2 ↑+H2O
100 44
12.5g.x 4.4g
![]()
X=80%
答:碳酸钙的质量分数为80%。
【解析】
试题分析: (1)H和I分别是烧杯和漏斗;
(2)制取二氧化碳的药品是固体与液体,制气装置选A或B,二氧化碳的密度比空气大,能溶于水,所以用向上排气法收集,收集装置选E;故仪器链接装置是AE或BE;二氧化碳的验满可用燃烧的木条放在瓶口处观察,火焰熄灭证明收集满;A、B装置相比,A能随时添加药品;
(3)用高锰酸钾制氧气时,可选用C装置;装药品前检查气密性,用D装置证明氧气收集满 ,现象是气泡从集气瓶口处逸出,这时先将导管移除水面,再熄灭酒精灯;
(4)木炭还原氧化铜需要高温条件下,酒精灯加一个金属网罩能集中温度,达到高温的目的;
(5)用装置F收集某气体,该气体应具备密度比空气小 ,不与空气反应的性质;
(6)制取氨气的药品都是固体,需要加热,可用高锰酸钾制氧气的装置,氨气的密度比空气小,采用向下排气法收集,从G中的b口进入符合要求;
(7)根据小强的实验数据,结合质量守恒定律可知,生成二氧化碳的质量是4.4g,再根据方程式,将4.4g二氧化碳带入方程式可求出碳酸钙的质量,最后求出石灰石中碳酸钙的质量分数。

 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案【题目】明星化学兴趣小组就空气中氧气的含量进行实验探究.
【集体讨论】
(1)讨论后同学们认为,选择的药品既要能消耗氧气,又不会跟空气中的其他成分反应,而且生成物为固体。他们应该选择(填编号) .
A、蜡烛 B、红磷 C、硫粉 D、光亮的铁丝
为了充分消耗容器中的氧气,药品的用量应保证 .
(2)小组同学共同设计了如下图的两套装置,你认为合理的是(填编号) .
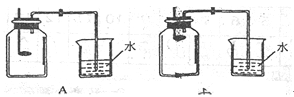
为了确保实验的成功,在装药品之前应该 .
【分组实验】
在讨论的基础上,他们分组进行了实验.
【数据分析】
实验结束后,整理数据见下表.(注:集气瓶容积为100 mL)
组 别 | 1 | 2 | 3 | 4 | 5 | 6 |
进入集气瓶中水的体积(mL) | 20 | 21 | 19 | 20 | 22 | 18 |
(3)通过对实验结果的交流,大多数同学都验证出氧气约占空气体积的 .通过实验还可推断集气瓶中剩余气体的性质是 .