题目内容
在宏观、微观和符号之间建立联系是化学学科的特点.
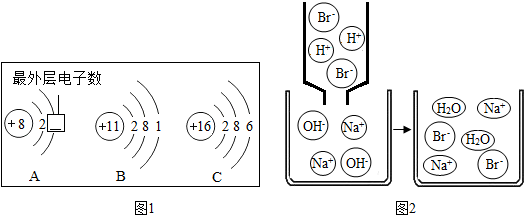
(1)在水、铜和氯化钠三种物质中,由分子构成的是______.
(2)某阳离子的结构示意图为 ,则x的数值可能是下列中的______.
,则x的数值可能是下列中的______.
A、9 B、10 C、11 D、12
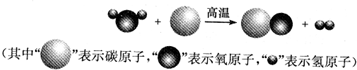
(3)净化物A可用气体燃料.在一定条件下,将一定质量的A与160gB按如图所示充分反应,当B反应完全时,生成132gC和77gD

①参加反应的A物质的质量是______.
②已知A的相对分子质量为44,该反应的化学方程式是______.
解:(1)在水、铜和氯化钠三种物质中,铜是金属由原子构成,氯化钠是由离子构成,水由分子构成;
(2)某阳离子的结构示意图为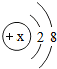 ,说明x>10,则x的数值可能是11或12;
,说明x>10,则x的数值可能是11或12;
(3)①由已知“将在一定条件下,将一定质量的A与160g B按如图所示充分反应,当B反应完全时,生成132gC和72gD”,根据质量守恒定律,则可求A参加反应的质量为:132+72-160=44克;
②结合模型图可推测C为二氧化碳,D为水,则“132gC中和72gD”二氧化碳中的碳元素的质量为132g×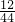 ×100%=36g,水中氢元素的质量为72g×
×100%=36g,水中氢元素的质量为72g×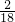 ×100%=8g;因为碳元素、氢元素都来自A,据反应前后元素的质量不变,可知A中氢、氧元素的质量分别是36g、8g,二者之和恰好是44g,说明A由碳元素和氢元素组成,故A中各元素的质量比m(C):m(H)=36:8,碳、氢原子个数比为:
×100%=8g;因为碳元素、氢元素都来自A,据反应前后元素的质量不变,可知A中氢、氧元素的质量分别是36g、8g,二者之和恰好是44g,说明A由碳元素和氢元素组成,故A中各元素的质量比m(C):m(H)=36:8,碳、氢原子个数比为: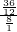 =3:8;已知A的相对分子质量为44,则A的化学式为C3H8,故该反应的化学方程式是C3H8+5O2
=3:8;已知A的相对分子质量为44,则A的化学式为C3H8,故该反应的化学方程式是C3H8+5O2  3CO2+4H2O;
3CO2+4H2O;
故答案为
(1)水;(2)CD;(3)①44g;②C3H8+5O2 3CO2+4H2O.
3CO2+4H2O.
分析:(1)依据物质的构成分析解答;
(2)阳离子是原子失去电子而形成的,所以其质子数>核外电子数,据此分析判断;
(3)根据质量守恒定律,可求A参加反应的质量;由“132gC和72gD”,结合模型图可推测C为二氧化碳,D为水,可以求出二氧化碳中的碳元素的质量,水中氢元素的质量,即A中各元素的质量比;已知A的相对分子质量为44和元素组成,可写出A的化学式,然后完成该反应的化学方程式;③根据反应的特点和化学变化的实质判断.
点评:本题主要考查了物质的构成、离子结构示意图,以及质量守恒定律的应用,原子个数比等于各元素的质量除以相对原子质量的比,方程式的书写等,从而培养了学生对知识的理解和应用.
(2)某阳离子的结构示意图为
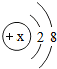 ,说明x>10,则x的数值可能是11或12;
,说明x>10,则x的数值可能是11或12;(3)①由已知“将在一定条件下,将一定质量的A与160g B按如图所示充分反应,当B反应完全时,生成132gC和72gD”,根据质量守恒定律,则可求A参加反应的质量为:132+72-160=44克;
②结合模型图可推测C为二氧化碳,D为水,则“132gC中和72gD”二氧化碳中的碳元素的质量为132g×
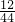 ×100%=36g,水中氢元素的质量为72g×
×100%=36g,水中氢元素的质量为72g×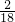 ×100%=8g;因为碳元素、氢元素都来自A,据反应前后元素的质量不变,可知A中氢、氧元素的质量分别是36g、8g,二者之和恰好是44g,说明A由碳元素和氢元素组成,故A中各元素的质量比m(C):m(H)=36:8,碳、氢原子个数比为:
×100%=8g;因为碳元素、氢元素都来自A,据反应前后元素的质量不变,可知A中氢、氧元素的质量分别是36g、8g,二者之和恰好是44g,说明A由碳元素和氢元素组成,故A中各元素的质量比m(C):m(H)=36:8,碳、氢原子个数比为: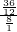 =3:8;已知A的相对分子质量为44,则A的化学式为C3H8,故该反应的化学方程式是C3H8+5O2
=3:8;已知A的相对分子质量为44,则A的化学式为C3H8,故该反应的化学方程式是C3H8+5O2  3CO2+4H2O;
3CO2+4H2O;故答案为
(1)水;(2)CD;(3)①44g;②C3H8+5O2
 3CO2+4H2O.
3CO2+4H2O.分析:(1)依据物质的构成分析解答;
(2)阳离子是原子失去电子而形成的,所以其质子数>核外电子数,据此分析判断;
(3)根据质量守恒定律,可求A参加反应的质量;由“132gC和72gD”,结合模型图可推测C为二氧化碳,D为水,可以求出二氧化碳中的碳元素的质量,水中氢元素的质量,即A中各元素的质量比;已知A的相对分子质量为44和元素组成,可写出A的化学式,然后完成该反应的化学方程式;③根据反应的特点和化学变化的实质判断.
点评:本题主要考查了物质的构成、离子结构示意图,以及质量守恒定律的应用,原子个数比等于各元素的质量除以相对原子质量的比,方程式的书写等,从而培养了学生对知识的理解和应用.

练习册系列答案
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
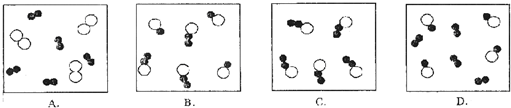
在宏观、微观和符号之间建立联系是化学学科的特点.现有A、B、C、D四种物质,其微观示意图见下表.
(1)1个B物质分子中有 原子.
(2)上述物质中属于单质的是 ,属于有机物的是 .[填写化学式]
(3)C物质中两种元素的质量比为 .
(4)将一定质量的A、B、C、D四种物质放在一密闭的容器内中,在电火花作用下,发生充分反应,测得反应前后各物质的质量如下:
其中,a值为 ,该反应的化学方程式中A与D的化学计量数之比为 .
| 物质 | A | B | C | D |  --氢原子 --氢原子 --碳原子 --碳原子 --氧原子 --氧原子 |
| 微观示意图 |  |
 |
 |
 |
(2)上述物质中属于单质的是
(3)C物质中两种元素的质量比为
(4)将一定质量的A、B、C、D四种物质放在一密闭的容器内中,在电火花作用下,发生充分反应,测得反应前后各物质的质量如下:
| A | B | C | D | |
| 反应前质量/g | 25 | 1 | 10 | 74 |
| 反应后质量/g | 9 | 37 | a | 10 |
 ”、“
”、“ ”、“
”、“ ”分别表示A、B、C三种物质的分子,下图表示某化学反应前后反应物与生成物分子及其数目的变化.该化学方程式中A、B、C前的化学计量数之比为
”分别表示A、B、C三种物质的分子,下图表示某化学反应前后反应物与生成物分子及其数目的变化.该化学方程式中A、B、C前的化学计量数之比为
 表示A元素的原子,
表示A元素的原子, 表示B元素的原子.某反应前后的物质微观示意图如下.
表示B元素的原子.某反应前后的物质微观示意图如下.
 和
和 中的
中的 属于同种元素,这是因为这些原子含有相同的
属于同种元素,这是因为这些原子含有相同的 表示甲元素的原子,
表示甲元素的原子, 表示乙元素的原子.某反应前后的物质微观示意图如下.
表示乙元素的原子.某反应前后的物质微观示意图如下.


 属于同种元素,这是因为这些原子含有相同的
属于同种元素,这是因为这些原子含有相同的