题目内容
探究实验(共8分)


二氧化碳的溶解性实验 氢氧化钠溶解于水
A B
(1)探究物质性质
上述A、B两个实验都是通过___ ____的变化来间接感知。B实验中___ ____(填a或b)处的水位升高的。
(2)探究可燃物燃烧条件

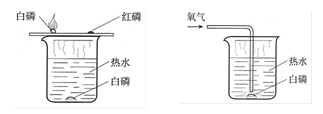
探究燃烧的条件
实验中探究可燃物的燃烧条件,它是通过控制可燃物是否与氧气接触和控制___ ____ 来探究可燃物燃烧的条件。能证明燃烧必须与氧气接触的实验现象是_____ _____;采用了___ ____的实验手段
(3)物质性质的应用:
|
实验序号 |
实验目的 |
实验方案 |
实验现象 |
结论 |
|
实验1 |
___ ____ |
|
___ ____
|
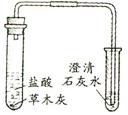
草木灰的主要成分是碳酸钾 |
(1)压强;b
(2)可燃物温度是否达到着火点。
A实验中水下的白磷不燃烧而铜片上的白磷燃烧;对比
(3)检验草木灰中是否含碳酸盐。产生能使澄清石灰水变浑浊的气体。
【解析】
试题分析:(1)A由于二氧化碳可溶于水,则瓶内的气体压强变小,所以瓶子会变瘪;B由于氢氧化钠溶于水时会放热,则温度升高,引起密闭容器的气体压强变大,所以b处的水位升高的,由此可知,A、B两个实验都是通过压强的变化来间接感知的。
(2)根据燃烧的条件分析:铜片上的白磷能燃烧,说明其满足燃烧的条件,既有氧气,同时又有热水为其提供了加热升温,使温度达到了白磷的着火点;而铜片上的红磷没有燃烧,是因为热水无法达到其着火点;水中白磷没有燃烧,是因为热水使烧杯内的白磷和空气隔绝了,但通入氧气后,热水中的白磷就可以燃烧了。由此可知,用铜片上的白磷和红磷的对比,可以探究温度是否达到着火点对燃烧的影响;而水中的白磷和水中通入氧气的白磷的对比可以探究与氧气的接触对燃烧的影响,所以实验中探究可燃物的燃烧条件,是通过控制可燃物是否与氧气接触和控制可燃物的温度是否达到着火点,来探究可燃物燃烧的条件的,本实验采用对比实验的形式。
(3)根据实验方案,向草木灰中滴加稀盐酸,并把产生的气体通入澄清石灰水,及所得结论草木灰主要成分为碳酸钾,可推知该实验的目的在于探究草木灰的主要成分是碳酸钾;实验中可观察到有大量气泡冒出,通入澄清的石灰水,石灰水会变浑浊,从而可得到草木灰中含有碳酸根的结论。
考点:燃烧的条件与灭火原理探究,证明碳酸盐(CO32-检验方法)
点评:对于验证型实验探究,要熟记物质的性质或变化规律,根据给出的实验设计方案,进行实验、分析和探究,并通过观察、记录和分析的实验现象,来验证该物质的性质或变化规律等。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案