题目内容
【题目】为测定鸡蛋壳中碳酸钙的含量(杂质不溶于水,也不与稀盐酸反应),某小组同学将鸡蛋壳清洗干净,晾干,取15 g鸡蛋壳研碎,逐滴加入稀盐酸,当加入94.4 g稀盐酸时恰好完全反应,反应产生的二氧化碳用足量的氢氧化钠溶液吸收,实验中氢氧化钠溶液的质量变化如图所示。请计算:
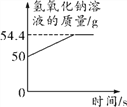
(1)生成二氧化碳的质量为________g。
(2)计算鸡蛋壳中碳酸钙的质量分数为________。(写出计算过程,结果精确到0.1%)
(3)计算反应后所得溶液的溶质质量分数为________。
【答案】 4.4 66.7% 11.1%
【解析】本题考查化学方程式与图像结合的计算,理解图像的含义是解题的关键。
(1)根据图示生成二氧化碳的质量为54.4g-54g=4.4g。
(2)设:生成4.4g二氧化碳需碳酸钙的质量为x
CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
100 44
X 4.4g
![]() =
=![]() x=10g
x=10g
鸡蛋壳中碳酸钙的质量分数为=![]() ×100%=66.7%
×100%=66.7%
(3)设:生成4.4g二氧化碳同时生成氯化钙质量为y
CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
111 44
y 4.4g
![]() y=11.1g
y=11.1g
反应后所得溶液的溶质质量分数=![]() ×100%=11.1%
×100%=11.1%

练习册系列答案
相关题目