题目内容
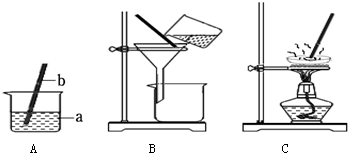
汕头是美丽的海滨城市,海洋是丰富的化学资源宝库,通过晾晒海水可以得到含有较多杂质的粗盐.(1)在做粗盐初步提纯的实验时,要进行如图所示的实验操作.

①操作B中玻璃棒的作用是______.
②操作C中看到______时,停止加热.
(2)用天平称量一定量的含氯化镁、硫酸钠和氯化钙的粗盐,并设计了如下流程进行除杂提纯,进一步得到较纯净的氯化钠固体.
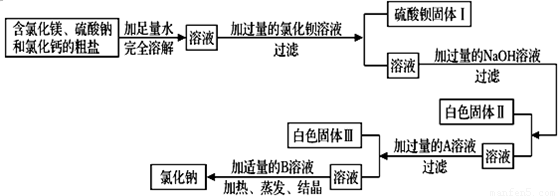
根据流程图回答下列问题:
①“加入过量的A溶液”,其中A试剂是______;
②写出反应流程中加入氯化钡溶液生成生成硫酸钡的化学反应方程式______;
③白色固体Ⅱ的成分是Mg(OH)2,白色固体Ⅲ的成分是______和______;
④加入适量B溶液,B溶液是______.
【答案】分析:(1)根据玻璃棒在过滤操作中的作用回答;
(2)根据实验步骤和加入的物质依次分析沉淀和溶液的成分,粗盐溶于水加入过量氯化钡后能生成硫酸钡沉淀,所得溶液中含有氯化钡,氯化镁,氯化钙杂质,再加入过量氢氧化钠后生成氢氧化镁沉淀,所得溶液中含有氯化钡,氯化钙和氢氧化钠杂质,此时应加入碳酸钠溶液,把钙离子和钡离子沉淀出来,溶液中含有碳酸钠和氢氧化钠,最后加入适量的稀盐酸把碳酸钠和氢氧化钠除去.
解答:解:(1)①玻璃棒在过滤操作中的作用是引流.②蒸发操作中看到蒸发皿中出现较多固体时,停止加热,用余热把水分蒸干.
(2)除去粗盐中的氯化钙,氯化镁和硫酸钠,除去钙离子用碳酸钠,除去镁离子用氢氧化钠,除去硫酸根用氯化钡,要注意加入试剂的顺序和量,后加入的试剂要把前面加入的过量试剂也除去;
①“加入过量的A溶液”的目的是除去氯化钙和氯化钡,所以A试剂是 Na2CO3;
②硫酸钠与加入的氯化钡溶液生成生成硫酸钡,化学方程式是BaCl2+Na2SO4═BaSO4↓+2NaCl;
③白色固体Ⅲ的成分是氯化钙和氯化钡与加入碳酸钠生成的,故沉淀是 CaCO3 BaCO3两种物质;
④加入适量B溶液时,原溶液中含有碳酸钠和氢氧化钠杂质,故加入的B溶液是稀盐酸,目的是除去过量的碳酸钠和氢氧化钠.
故答案为:(1)引流;较多固体;(2)①Na2CO3②BaCl2+Na2SO4═BaSO4↓+2NaCl
③CaCO3;BaCO3④稀盐酸.
点评:玻璃棒在溶解时搅拌是为了加速物质溶解,或让物质充分混合,过滤时引流是防止液体溅出和冲破滤纸,蒸发是搅拌是防止液体飞溅.
(2)根据实验步骤和加入的物质依次分析沉淀和溶液的成分,粗盐溶于水加入过量氯化钡后能生成硫酸钡沉淀,所得溶液中含有氯化钡,氯化镁,氯化钙杂质,再加入过量氢氧化钠后生成氢氧化镁沉淀,所得溶液中含有氯化钡,氯化钙和氢氧化钠杂质,此时应加入碳酸钠溶液,把钙离子和钡离子沉淀出来,溶液中含有碳酸钠和氢氧化钠,最后加入适量的稀盐酸把碳酸钠和氢氧化钠除去.
解答:解:(1)①玻璃棒在过滤操作中的作用是引流.②蒸发操作中看到蒸发皿中出现较多固体时,停止加热,用余热把水分蒸干.
(2)除去粗盐中的氯化钙,氯化镁和硫酸钠,除去钙离子用碳酸钠,除去镁离子用氢氧化钠,除去硫酸根用氯化钡,要注意加入试剂的顺序和量,后加入的试剂要把前面加入的过量试剂也除去;
①“加入过量的A溶液”的目的是除去氯化钙和氯化钡,所以A试剂是 Na2CO3;
②硫酸钠与加入的氯化钡溶液生成生成硫酸钡,化学方程式是BaCl2+Na2SO4═BaSO4↓+2NaCl;
③白色固体Ⅲ的成分是氯化钙和氯化钡与加入碳酸钠生成的,故沉淀是 CaCO3 BaCO3两种物质;
④加入适量B溶液时,原溶液中含有碳酸钠和氢氧化钠杂质,故加入的B溶液是稀盐酸,目的是除去过量的碳酸钠和氢氧化钠.
故答案为:(1)引流;较多固体;(2)①Na2CO3②BaCl2+Na2SO4═BaSO4↓+2NaCl
③CaCO3;BaCO3④稀盐酸.
点评:玻璃棒在溶解时搅拌是为了加速物质溶解,或让物质充分混合,过滤时引流是防止液体溅出和冲破滤纸,蒸发是搅拌是防止液体飞溅.

练习册系列答案
相关题目