题目内容
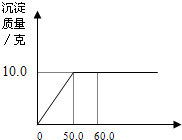 向一定量含有NaCl和CaCl2的混合溶液中逐滴加入溶质质量分数为21.2%的Na2CO3溶液,所加入Na2CO3溶液的质量与生成沉淀质量的关系如图所示,求:
向一定量含有NaCl和CaCl2的混合溶液中逐滴加入溶质质量分数为21.2%的Na2CO3溶液,所加入Na2CO3溶液的质量与生成沉淀质量的关系如图所示,求:(1)原混合溶液中氯化钙的质量.
(2)若恰好完全反应后得到溶质质量分数为12.0%的溶液195g,则原混合溶液中氯化钠的质量分数是多少?
分析:根据题意可知,混合溶液中加Na2CO3溶液,只发生CaCl2和Na2CO3的化学反应,再利用图可知,加50.0gNa2CO3溶液恰好完全反应,把碳酸钙的质量代入化学方程式进行计算.
解答:解:设原混合溶液中氯化钙的质量为x,则
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 100
x 10.0g
=
解得x=11.1g
答:原混合溶液中氯化钙的质量为11.1g;
(2)由质量守恒可知,原溶液的质量为(195g+10g)-50g=155g,
设反应生成的氯化钠的质量为y,则
CaCl2+Na2CO3═CaCO3↓+2NaCl
100 117
10.0g y
=
解得y=11.7g,
则原溶液中氯化钠的质量为:195×12%-11.7g=11.7g,
原混合溶液中氯化钠的质量分数为
×100%≈7.5%,
答:原混合溶液中氯化钠的质量分数为7.5%.
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 100
x 10.0g
| 111 |
| 100 |
| x |
| 10.0g |
解得x=11.1g
答:原混合溶液中氯化钙的质量为11.1g;
(2)由质量守恒可知,原溶液的质量为(195g+10g)-50g=155g,
设反应生成的氯化钠的质量为y,则
CaCl2+Na2CO3═CaCO3↓+2NaCl
100 117
10.0g y
| 100 |
| 117 |
| 10.0g |
| y |
解得y=11.7g,
则原溶液中氯化钠的质量为:195×12%-11.7g=11.7g,
原混合溶液中氯化钠的质量分数为
| 11.7g |
| 155g |
答:原混合溶液中氯化钠的质量分数为7.5%.
点评:本题考查利用化学反应方程式的计算,学生能利用图明确碳酸钙的质量是解答的关键,在本题中学生还应注意质量守恒、注意物质的变化等来解答.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目

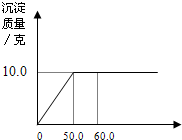 向一定量含有NaCl和CaCl2的混合溶液中逐滴加入溶质质量分数为21.2%的Na2CO3溶液,所加入Na2CO3溶液的质量与生成沉淀质量的关系如图所示,求:
向一定量含有NaCl和CaCl2的混合溶液中逐滴加入溶质质量分数为21.2%的Na2CO3溶液,所加入Na2CO3溶液的质量与生成沉淀质量的关系如图所示,求: