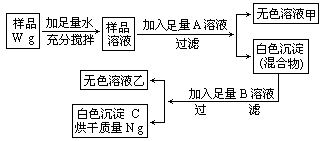
题目内容
某碳酸钠固体样品中含有少量氯化钠.研究性学习小组的同学在探究该固体混合物中碳酸钠的质量分数时,设计并完成以下实验.①取质量为a g的三个烧杯,各盛放质量分数相同的稀盐酸25g;
②向三个烧杯中分别放入质量不同的固体样品;
③充分反应后,称量烧杯和剩余物的质量.实验数据如下表.
| 所称量的物质 | 实验1 | 实验2 | 实验3 |
| 烧杯+稀盐酸(g) | a+25 | a+25 | a+25 |
| 加入的固体样品(g) | 3.2 | 6.6 | 7.6 |
| 充分反应后,烧杯+剩余物(g) | a+27.1 | a+29.4 | a+30.4 |
求:(1)该固体样品中含碳酸钠的质量分数;
(2)所用盐酸溶液的质量分数.
【答案】分析:比较实验2和实验3可以知道加入固体样品实验3比实验2多1g,而剩余的固体的质量也是1g,所以可以判断实验2中的盐酸完全反应,比较实验1和实验2可以知道:实验2加入的固体比实验1中多加了3.4g固体样品,而反应后溶液只增加了2.3g,说明实验1中的3.2g样品中的碳酸钠全部发生了反应,所以综合以上的分析可以得出实验1中的固体样品完全反应,可以据此结合化学方程式来进行求解.
解答:解:比较实验2和实验3可以知道加入固体样品实验3比实验2多1g而剩余的固体的质量也是1g,所以可以判断实验3中的盐酸完全反应,比较实验1和实验2可以知道实验2加入的固体比实验1中多加了3.4g固体样品,而反应后溶液只增加了2.3g说明实验1中的3.2g样品中的碳酸钠全部发生了反应,所以综合以上的分析可以判断实验2中的盐酸已反应完全,实验2中生成气体的质量为:(a+25g)+6.6g-(a+29.4g)=2.2g
分析可以知道实验1的固体样品恰好完全反应,根据质量守恒定律可以知道生成气体的质量为:(a+25g)+3.2g-(a+27.1g)=1.1g;
设6.6g样品中含碳酸钠的质量为x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x 1.1g
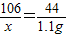
解得:x=2.65g
(1)该固体样品中含碳酸钠的质量分数为: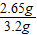 ×100%=82.8%
×100%=82.8%
(2)设25g盐酸中含氯化氢的质量为y,
Na2CO3+2HCl═2NaCl+H2O+CO2↑
73 44
y 2.2g
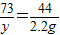
解得:y=3.65g
盐酸溶液的质量分数为: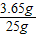 ×100%=14.6%.
×100%=14.6%.
答:该固体样品中含碳酸钠的质量分数为82.8%;
(2)所用盐酸溶液的质量分数14.6%.
故答案为:
2和3;
(1)82.8%;
(2)14.6%.
点评:本题难度较大,主要考查了通过表格分析有价值的数据,然后根据化学方程式进行有关量的计算,培养学生的分析能力和解决问题的能力.
解答:解:比较实验2和实验3可以知道加入固体样品实验3比实验2多1g而剩余的固体的质量也是1g,所以可以判断实验3中的盐酸完全反应,比较实验1和实验2可以知道实验2加入的固体比实验1中多加了3.4g固体样品,而反应后溶液只增加了2.3g说明实验1中的3.2g样品中的碳酸钠全部发生了反应,所以综合以上的分析可以判断实验2中的盐酸已反应完全,实验2中生成气体的质量为:(a+25g)+6.6g-(a+29.4g)=2.2g
分析可以知道实验1的固体样品恰好完全反应,根据质量守恒定律可以知道生成气体的质量为:(a+25g)+3.2g-(a+27.1g)=1.1g;
设6.6g样品中含碳酸钠的质量为x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x 1.1g
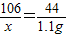
解得:x=2.65g
(1)该固体样品中含碳酸钠的质量分数为:
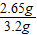 ×100%=82.8%
×100%=82.8%(2)设25g盐酸中含氯化氢的质量为y,
Na2CO3+2HCl═2NaCl+H2O+CO2↑
73 44
y 2.2g
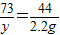
解得:y=3.65g
盐酸溶液的质量分数为:
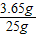 ×100%=14.6%.
×100%=14.6%.答:该固体样品中含碳酸钠的质量分数为82.8%;
(2)所用盐酸溶液的质量分数14.6%.
故答案为:
2和3;
(1)82.8%;
(2)14.6%.
点评:本题难度较大,主要考查了通过表格分析有价值的数据,然后根据化学方程式进行有关量的计算,培养学生的分析能力和解决问题的能力.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目